Лектин
Cтраница 2
Лектин соевых бобов имеет сродство к терминальным а - и fl - галактопиранозильным и a - N-ацетилгалактопиранозильным остаткам. Тетрамер имеет два места связывания N-ацетилгалактозамина. [16]
Лектин виноградной улитки ( Helix pcmatia) был недавно выделен из белковой железы ( части полового аппарата) этого беспозвоночного, где он содержится в количестве до 8 % всего белка. Он агглютинирует человеческие эритроциты группы А, но не В или О. Строение и свойства его довольно хорошо изучены. [17]
Лектинами называют белки или гликопротеиды растительного ( фитогемагглютинины) или животного происхождения, проявляющие более или менее избирательное сродство к остаткам индивидуальных Сахаров или групп сходных Сахаров. Разнообразие остатков Сахаров, часто встречающихся в природе, невелико, но они входят в самых различных комбинациях во множество биологически важных соединений: полисахаридов, мукополисахаридов, гликопротеидов, глико-липидов и др. Многие из этих соединений участвуют в построении клеточных мембран. Подобно антителам, лектины обладают более чем одним участком связывания Сахаров, что обусловливает их способность агглютинировать эритроциты и другие клетки, отбирая их по классам, например опухолевые или эмбриональные. [18]
Первым лектином, который нашел применение для хроматографии углеводов, был конканавалин А ( из канавалии мечевидной Canavalia ensiformis), который представляет собой метал-лопротеин, содержащий Мп2 и Са2, чье присутствие необходимо для проявления связывающей активности. В результате дальнейших интенсивных исследований было установлено, что любые изменения при С-3, С-4 или С-6 в остатке моносахарида, участвующего в связывании, существенным образом сказываются на степени комплексообразования с конканавалином А, тогда как даже значительные вариации при С-2 гораздо меньше отражаются на эффективности связывания. [19]
Некоторые лектины оказались высоко специфичными. [20]
Впервые лектины выделены в конце 19 века из бобовых культур и обнаружены по способности агглютинировать эритроциты животных, которую можно предотвратить добавлением определенного сахарида. [21]
Проблема лектинов привлекает внимание во многих аспектах. Так, специфически связывая углеводы и углеводсодержащие биополимеры, лектины оказывают влияние на многие биологические процессы; они неоценимы для количественного выделения и тонкой характеристики углеводов и других веществ, содержащих углеводные остатки; лектинами стали пользоваться для изучения молекулярной архитектуры клеточной поверхности и ее изменений. Важную роль лектины играют и в процессах узнавания. Так, например, есть данные, что азотфиксирующие микроорганизмы узнают корневые волоски бобовых растений вследствие взаимодействия полисахаридов и липополи-сахаридов оболочек микроорганизмов с лектинами растений. [22]
Реакция лектина с полисахаридом аналогична реакции антиген - антитело. При этом лектин играет роль поливалентного ( обычно двухвалентного антитела), а полисахарид - поливалентного антигена. [23]
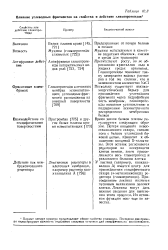 |
Влияние углеводных фрагментов на свойства и действие гликопротеидов1. [24] |
Присоединение лектина является пусковым механизмом деления клетки. Лектины могут дать важные сведения для выяснения этого процесса. [25]
Среди растительных лектинов, специфически связывающихся с D-галактозными остатками белков ( гликопро-теидов) клеточной мембраны животных клеток, имеется ряд сильных токсинов, ингибирующих белковый синтез в клетках-мишенях. Эти белки обнаруживают поразительное сходство с бактериальными токсинами, и в частности, с дифтерийным токсином, в отношении их молекулярно-функциональной организации. [26]
Связывание лектинами углеводных остатков происходит по крайней мере в нескольких изученных случаях посредством образования нековалентных главным образом водородных связей. [27]
Белков и лектины также присоединяются непосредственно к СКВг-активированной агарозс через амино. [28]
Анти-А - лектин, получаемый из лимской фасоли, несколько менее специфичен. Концентрированные растворы этого лектина хотя и слабо, но агглютинируют также и эритроциты группы В. Еще менее специфичны анти - Н - лектины: их достаточно концентрированные растворы могут агглютинировать также эритроциты подгруппы AI и группы В. Это, однако, может быть следствием того, что в эритроцитах человека, принадлежащих к этим группам, содержится Н - антиген. [29]
Наиболее изучен лектин из бобов Canavalia ensiformis - конканавалин А. Это белок с молекулярной массой 102 000, построенный из четырех идентичных субъединиц и имеющий четыре центра связывания углеводов. При понижении рН и температуры конканавалин А переходит в форму димера. Полипептидные цепи белка имеют не совсем обычную укладкучв которой отсутствуют а-спиральные участки, более 50 о цепи мономера образуют трехслойную ( 1-структуру. Для связывания углеводов важны ионы металлов Са и Мп; пока не заняты два участка связываний металлов, присоединение углеводов не происходит. [30]
Страницы: 1 2 3 4