Лефтин
Cтраница 2
Отнесение соединения, обусловливающего полосу поглощения при 607 ммк, к я-комплексу или к комплексу с переносом заряда было подвергнуто критике Лефтином и Холлом ( 1962) по нескольким причинам. Эта теория не может объяснить наблюдаемое влияние окислителей. [16]
Являясь удовлетворительной во многих отношениях, эта теория не объясняет кажущуюся связь между интенсивностью полосы при 607 ммк и интенсивностью сигнала ЭПР, найденную Лефтином и Холлом для дифенилэтилена, восстановленного щелочными металлами в растворах органических растворителей. [17]
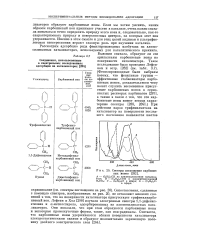 |
Спектры поглощения карбоние. [18] |
Сопоставления, сделанные с помощью спектров, изображенных на рис. 20, не оставляют никаких сомнений в том, что на поверхности катализатора присутствует трифенилкарбо-ниевый ион. Лефтин и Хол [290] изучали электронные спектры 1 1-дифенил-этилена и а-метилстирола, адсорбированных на алюмосиликатных катализаторах. Они показали, что при этом образуются карбониевые ионы и некоторые промежуточные формы, такие, как ион-радикалы. [19]
Правильность отнесения полосы при 600 ммк в спектре дифенилэтилена, адсорбированного на алюмосиликате, к катион-радикалу [ ( С6Н5) 2С CH2 ] t вызывает сомнения, поскольку в данной работе отсутствуют сведения о появлении сигнала в спектре ЭПР адсорбированного соединения. Однако позднее Лефтин, Хобсон и Лиг ( 1962) получили доказательства существования парамагнитной структуры при адсорбции дифенилэтилена на алюмосиликате. [20]
 |
Кювета для спектроскопического изучения катализаторов в видимой и ультрафиолетовой областях спектра. [21] |
На рис. 19 показана типичная оптическая кювета, пригодная для проведения спектральных исследований в видимой и ультрафиолетовой областях спектра. Эта кювета сконструирована Лефтином [264, 282], который также разработал другую кювету [283], позволяющую выполнять исследования как в инфракрасной, так и в ультрафиолетовой областях спектра. [22]
Роль следов кислорода в системе олефин - катализатор неясна. Фого ( 1961) сообщил о данных об увеличении сигнала ЭПР при добавлении кислорода к адсорбированным полиароматическим молекулам. С другой стороны, Лефтин, Хобсон и Лиг ( 1962) и Руни и Пинк ( 1962) нашли, что добавление кислорода уширяет и ослабляет сигнал ЭПР парамагнитных соединений, образовавшихся при адсорбции ароматических молекул и олефинов на алюмосиликате. [23]
Однако не было доказано, что ион карбония, дающий в ультрафиолетовом спектре полосу при 300 ммк, может приводить к появлению относительно интенсивных полос поглощения ниже 3000 см 1, наблюдаемых в инфракрасном спектре. Опыты, проводившиеся при высоких заполнениях, приводили к образованию насыщенных полимерных структур. С этой точки зрения полосы поглощения, обнаруженные Лефтином и Хобсоном, вероятно, принадлежат насыщенным полимерам бутена. [24]
Второй критерий отнесения спектральной полосы при 6050 А к катион-радикалу базируется на демонстрации того, что соответствующий катион-радикал, имеющий аналогичный спектр, может образоваться из этого олефина. Анион-радикалы ряда диарил - и тетраарилолефинов были получены по реакции этих углеводородов с щелочными металлами в диглимовой) среде или в тетра-гидрофуране [119]; однако эти исследования не коснулись 1 1-ди-фенилэтилена. Для того чтобы получить дальнейшие подтверждения их спектрального отнесения, Лефтин и Холл [83] исследовали спектры аддуктов ДФЭ с щелочными металлами в растворе тетра-гидрофурана. Когда раствор ДФЭ в тетрагидрофуране обработали литием, натрием или калием, вначале появилась интенсивная синяя окраска ( 6070 А), затем перешедшая в темно-красную ( К - 4750 А), как только прореагировала большая часть щелочного металла. [25]
Как следует из рис. 34, кислотные центры rf А1 О В203 имеют исключительно бренстедовский характер с максимумом кислотности при концентрации В203 15 вес. Результаты для у - А1203 В203 были практически идентичны. Общая концентрация кислотных центров с Я0 1 5 измерялась методом аминного титрования, кислотность Льюиса - усовершенствованным методом Лефтина и Холла ( разд. Бренстеда определялась по разности между общей кислотностью и кислотностью Льюиса ( разд. [26]
Вероятно, полоса иона карбония при 420 ммк исчезала вследствие образования соответствующего спирта с добавляемой водой. Однако Лефтин и Хобсон не считали, что это возможно, так как добавление воды к катализатору, содержащему ион трифенилметилкарбония, приводило к образованию трифенилметана, а не трифенилметанола. [27]
Гудри имеются как бренстедовские, так и льюисовские центры. Эти результаты были подтверждены Базила и др. [363], применившими тот же метод. Обработка ацетатом калия ослабляет кислотность большинства льюисовских центров и полностью уничтожает бренстедовские центры. Вода, необратимо адсорбировавшаяся при комнатной температуре, превращала координационно связанный пиридин в ионы пиридиния. Аналогичный эффект наблюдали Лефтин и Холл [364]: электронный спектр хемосорбированных ионов карбония исчезал при добавлении воды и вновь появлялся после непродолжительной откачки. Модель, сформулированная Базила и др. [363], предполагает, что все первичные кислотные центры являются льюисовскими, локализованными на ионе алюминия, а предполагаемые бренстедовские центры образуются при вторичном взаимодействии между молекулами, адсорбированными на льюисовских центрах, и соседними поверхностными гидроксиль-ными группами, являющимися силанольными. [28]
Страницы: 1 2