Лецитиназа
Cтраница 2
Последние обладают сильным гемолитич. Лецитиназа А содержится в соке поджелудочной железы животных и человека. Очень активная лецитиназа А содержится в ядах нек-рых насекомых и змей ( скорпионов, пчел, ос, кобр), с чем связано их токсич. А, сразу же инак-тивируются в результате действия на них лецитиназы В. [16]
В ( лизолецитиназа В, фосфолипаза В, лизофосфолипаза) - - катализирует гидролитическое расщепление эфирной связи в р-положе-нии молекулы а-лизолоцитина или а-лизокефалина с образованием молекулы жирной кислоты и гли-церилфосфорилхолина или глицерилфосфорилэтанола-мина. Лецитиназа В содержится в соке поджелудочной железы, а также в тканях животных и растений. [17]
Лецитиназа С ( фосфолипаза С, а-токсин) - катализирует гидролитич. Лецитиназа С входит в состав бактериальных токсинов. Ионы Си, Sr, Fe И Ва сильно тормозят этот фермент. В небольших количествах лецитиназа С обнаружена в связанном состоянии в тканях животных, в частности в тканях мозга. [18]
 |
Хроматографирование активной. [19] |
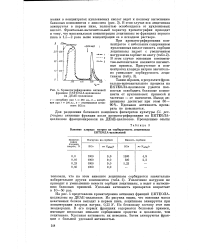
На рис. 4 представлена хроматограмма активных фракций ЕКТЕОЛА-целлюлозы на ДЕАЕ-целлюлозе. Из рисунка видно, что основная масса неактивных белков выходит в первом пике, лецитиназа элюируется при концентрации хлорида натрия, 0 25 N. По белковому составу этот пик неоднороден. В его первых фракциях содержатся белковые примеси, имеющие несколько меньшее сорбционное сродство к целлюлозе, чем лецитиназа. Удельная активность их невелика. Затем элюируются фракции с большей удельной активностью. [20]
Об обмене фосфатидов мы почти ничего не знаем. Известно только, что в кишечнике, почках, печени и других органах присутствует лецитиназа. [21]
Так, Clostridium welchii - палочкообразный микроб, обычно обнаруживаемый при газовой гангрене, - выделяет фермент, называемый лецитиназой. Он разрушает эритроциты, разлагая вещество лецитин, имеющееся в их оболочке. Яд кобры и гремучей змеи также содержит лецитиназу. Тот же микроб выделяет еще и фермент, который растворяет белок соединительной ткани мышц, а газ, выделяющийся при газовой гангрене, образуется в результате действия группы ферментов, ускоряющих патологическую разновидность брожения. Действие многих препаратов и ядов также связано с ферментативными реакциями. [22]
Первое обширное исследование ферментов мозга было произведено Б. И. Словцовым ( 1921), который открыл в сером ветгестве мозга человека ряд ферментов, катализирующих превращения белков, углеводов и липидов. Благодаря работам Б. И. Словцова, а также более поздним исследованиям других ученых в мозгу были найдены: амилаза, мальтаза, лак-таза, сахараза, фосфор и лаз а, различные фосфа-тазы, липаза, лецитиназа, нуклеаза, протеазы, холинэстераза, холинацетилаза, карбоангидра-за, каталаза, пероксидаза, цитохромная система, дегидрогеназы и группа ферментов, осуществляющих гликолиз. [23]
Последние обладают сильным гемолитич. Лецитиназа А содержится в соке поджелудочной железы животных и человека. Очень активная лецитиназа А содержится в ядах нек-рых насекомых и змей ( скорпионов, пчел, ос, кобр), с чем связано их токсич. А, сразу же инак-тивируются в результате действия на них лецитиназы В. [24]
Таким образом, в опытах Масуда имеются некоторые, хотя и косвенные доказательства того, что ауксин может изменять способность поверхности клетки связывать катионы, в частности кальций клеточной стенки, что приводит к ее размягчению. Эта мысль впервые была высказана Беннет-Кларком ( Bennet-Clark, 1956), который предположил, что кальций клеточных стенок или другие катионы образуют комплекс с лецитином или соответствующим липопротеидом поверхностной мембраны, которые действуют как переносчики, транспортирующие катионы через мембрану. На внутренней стороне мембраны этот комплекс расщепляется лецитиназой до холина и фосфатидюювой кислоты, в результате чего катионы освобождаются. Эти процессы идут с затратой энергии АТФ. При участии холинэстеразы в наружной стороне мембраны происходит ресинтез переносчика. По-видимому, перенос ионов с участием фосфолипидов мембран имеет место в растительных клетках. На это указывают данные Кана и Хенсона ( Kahn, Hanson, 1959), которые установили зависимость поглощения калия митохондриями от синтеза и разрушения фосфолипидов. Однако Борус и Боннер ( Boroughs, Bonner, 1953) не обнаружили активирующего влияния ауксина на включение ацетата - С14 в липиды, а Ненс ( Nance, 1958) показал, что ИУК даже ингибирует включение ацетата - С14 в липиды отрезков стеблей гороха. [25]
Попадая в рану, гангренозные формы анаэробов вызывают быстро распространяющееся разрушение мышечной ткани, сопровождающееся накоплением в ткани водорода. Возбудители вырабатывают сильнодействующие экзотоксины. Наиболее изучен альфа-токсин, выделяемый Cl. Лецитиназа также лизирует и красные кровяные тельца. [26]
 |
Хроматографирование активной. [27] |
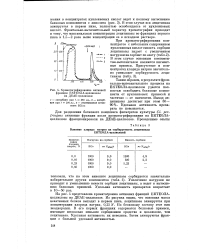
На рис. 4 представлена хроматограмма активных фракций ЕКТЕОЛА-целлюлозы на ДЕАЕ-целлюлозе. Из рисунка видно, что основная масса неактивных белков выходит в первом пике, лецитиназа элюируется при концентрации хлорида натрия, 0 25 N. По белковому составу этот пик неоднороден. В его первых фракциях содержатся белковые примеси, имеющие несколько меньшее сорбционное сродство к целлюлозе, чем лецитиназа. Удельная активность их невелика. Затем элюируются фракции с большей удельной активностью. [28]
Установлено, что потенциальная инсектицидная активность шести видов бацилл ( Вас. АТСС 4633)) зависит не от наличия протеиназы и лецитиназы, а от присутствия сс-экзотоксина; для Вас. Hi-серотип) дополнительный эффект оказывает р-токсин. У этого штамма не выявлены лецитиназа, а-и Р - ЭКЗОТОКСИНЫ, хотя имелась протеиназа. [29]
В противоположность простым липидам сложные липиды - фосфатиды, цереброзиды и холестерин - являются жизненно необходимыми липидами. Даже в периоды голодовок содержание этих липидов в клеточной протоплазме не изменяется. Лецитины необходимы для усвоения жиров, они содействуют проникновению липидов через стенки клеток. Цефалины способствуют свертыванию крови. Сфингомиелины содержатся в мозгу и нервных тканях, но их роль пока неизвестна. Интересно отметить, что яд кобр, некоторых насекомых и пауков содержит фермент, называемый лецитиназой. Этот фермент гидролизует среднюю сложноэфирную связь лецитинов. Образующийся продукт называется лизолецити-ном. Лизолецитин гемолизирует красные кровяные клетки и разрушает ткани, находящиеся рядом с местом образования леци-тиназы. [30]
Страницы: 1 2 3