Надперекись
Cтраница 3
Этими исследованиями было установлено, что взаимодействие надперекисей с углекислым газом идет только в присутствии водяного пара. Роль последнего заключается в том, что взаимодействуя с надперекисями на первой стадии, водяной пар подвергает их гидролизу. В различных температурных условиях этот гидролиз протекает по-разному. [31]
Разработан непрерывный и эффективный лабораторный способ синтеза надперекиси цезия высокой чистоты, основанный на распылении металлического цезия в атмосферу кислорода и аргона. [32]
Для более тяжелых ЩЭ особые условия для синтеза надперекисей не нужны - это связано с уменьшением поляризующего действия М в ряду Li-Cs. Однако более глубокое окрашивание надперекисей, по сравнению с перекисями и нормальными окислами, говорит о переносе заряда в этих соединениях, который в случае производных однозарядных катионов ЩЭ, обладающих благородно-газовой электронной оболочкой, может иметь только поляризационную природу. Очевидно, растущая в ряду 1Л - Cs деформируемость ионов ЩЭ приводит к стабилизации надперекисей, неустойчивых в случае других элементов-металлов. [33]
Остальными способами получаются смеси, содержащие наряду с надперекисью перекись и гидроокись цезия. [34]
При реакции гидроокисей калия и цезия с озоном образуются Надперекиси и CsOj. Обе они растворяются в жидком аммиаке с образованием растворов красного цвета. В соответствии с этой структурой соединения парамагнитны. [35]
Но в общем перекиси щелочных металлов, а также надперекиси достаточно устойчивы при нагревании, если только к ним не примешаны способные к окислению вещества. Однако последним они легко отдают свой кислород при нагревании, притом даже таким веществам, которые в других условиях окисляются лишь с трудом. Поэтому перекиси щелочных металлов, особенно перекись натрия, применяют в лаборатории для перевода в растворимое состояние способных к окислению веществ, нерастворимых в кислотах. [36]
В табл. 88 и 89 перечислены известные перекиси и надперекиси элементов в порядке положения, занимаемого этими элементами в периодической системе. Хотя, строго говоря, надперекиси принадлежат к совершенно отдельному классу соединений, все же целесообразно рассмотреть их вместе с перекисями ввиду аналогии, существующей между способами образования и реакциями соединений обоих типов. Ниже приведены дальнейшие подробности, касающиеся характеристики надперекисей. [37]
Устойчивость перекисей ( содержащих ноны О1 -) и надперекисей ( содержащих ионы СЬ) можно объяснить большими размерами соответствующих катионов, которые обычно дают устойчивые кристаллы с большими анионами; катионы меньшего размера не смогли бы сохранять достаточное расстояние между большими анионами ОН и СЬ в перекисях и надпе-рекисях. Так, перекись лития удалось получить с большими трудностями, а перекись бериллия вообще неизвестна. [38]
Окислы с формулой М2О3 занимают промежуточное положение между перекисями и надперекисями; предполагается, что все щелочные металлы, за исключением лития, образуют такие окислы или при нагревании надперекисей, или при действии кислорода на раствор щелочного металла в жидком аммиаке. Однако в результате изучения скорости процесса разложения 2КО2 - - К2О2 - Ь 2 установлено, что при разложении КО2 промежуточный продукт К2О3 не образуется; таким образом, доказательство существования этих соединений не является удовлетворительным. Невидимому, можно утверждать, что отдельного иона 0 - не существует. [39]
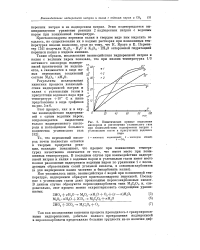 |
Кинетические кривые выделения кислорода и поглощения углекислого газа при взаимодействии надперекиси натрия с углекислым газом в присутствии водяного пара. [40] |
Как указывалось выше, взаимодействуя с водой при пониженной температуре, надперекиси образуют кристаллогидраты перекисей. Последние с углекислым газом дают производные пероксокарбоновых кислот. [41]
Пероксиды и супероксиды являются солями слабых кислот - перекиси водорода и надперекиси водорода НО2, существующей в виде солей. [42]
При этом образуются соединения с высоким содержанием кислорода - перекиси и надперекиси рубидия. Не менее жадно ( с воспламенением) соединяется он с хлором и другими галогенами, а с серой и фосфором - даже со взрывом. [43]
Однако фактически эти соединения представляют собой, вероятно, лишь сочетания надперекисей и перекисей. [44]
Они называются супероксидами по международной номенклатуре, а по русской - надперекисями. [45]
Страницы: 1 2 3 4