Пентаборан
Cтраница 3
В присутствии пентаборана бес цветное пламя водорода окраши вается в зеленый цвет. Интенсивность окраски пропорциональна концентра ции пентаборана. [31]
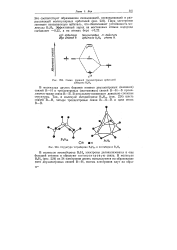 |
Схема уровней трехцентровых орбиталей диборана В2Н6.| Структура тетраборана В4Н10 и пентаборана В5Н9. [32] |
В молекуле пентаборана В6Н9 электроны делокализованы в еще большей степени и образуют пятицентровую связь. [33]
Смеси паров пентаборана с воздухом взрывоопасны и способны к самовоспламенению. Пентаборан чрезвычайно ядовит, вызывает поражение центральной нервной системы. [34]
Другим преимуществом пентаборана является значительно более высокая скорость сгорания по сравнению с бензином, что делает возможным применение более коротких камер сгорания и, следовательно, двигателей меньшего веса. [35]
 |
Строение пентаборана-9. [36] |
Известны два пентаборана: пентаборан-9, В5Н9, называемый иногда просто пентабораном или устойчивым пентабораном, и пентаборан-11, В5НИ, который называют также дигидропентабораном или неустойчивым пентабораном. [37]
При реакции пентаборана с этиленом в условиях электрофильного замещения в присутствии А1С13 получается этилпентаборан [97, 104]; хроматогра-фически и с помощью ИК - и ЯМР-спектров показано, что в этих условиях происходит замещение только водорода, связанного с вершинным атомом бора. [38]
В молекуле пентаборана BjHg электроны делокализованы в еще большей степени и образуют пяти центровую связь. В молекуле B Hg ( рис. 187) из 24 электронов десять используются на образование пяти двухцентро-вы Х связей В - Н, восемь - на образование четырех трехцентровых1 связей В - Н - В, а остальные шесть электронов участвуют в построении пятицентровой связи, охватывающей остов и з пяти атомов бора; Вследствие делокайизаций связи Координационное число бора в пентаборане достигает шести. [39]
В молекуле пентаборана ВГ Нц электроны делокализованы в еще большей степени и образуют пятицентровую связь. [40]
Более опасными являются пентаборан и декаборан, поражающие центральную нервную систему. По степени токсичности пентаборан близок к синильной кислоте. После отравления в течение некоторого времени наблюдаются сильные головные боли. Пентаборан и декаборан обладают кумулятивным действием. [41]
С хлористым водородом пентаборан не взаимодействует даже при 100 С и в присутствии катализаторов, но медленно реагирует с бромистым и йодистым водородом. [42]
С хлоридом бора пентаборан не взаимодействует. [43]
Установлено, что пентаборан является эффективной добавкой ( 10 %) к обычным топливам, которая повышает скорость горения и препятствует срыву пламени. [44]
Изучены диффузия пламени пентаборана в воздухе и взрывае-мость смесей пентаборана в воздухе и при поджигании паров пентаборана, разбавленных азотом, к которым добавлен кислород. [45]
Страницы: 1 2 3 4