Замерзание - чистая вода
Cтраница 3
Всякая жидкость начинает замерзать при той температуре, при которой она будет иметь такое же давление пара, как и твердые кристаллы этой жидкости. Точке Л - отвечает температура 0 С. Эта температура и является точкой замерзания чистой воды. [31]
Криоскоп ( рис. 44) состоит из широкой пробирки 1 с наклонной трубкой сбоку, в которую наливают исследуемый раствор. Пробирку вставляют в сосуд 3 со смесью льда с солью. В момент остановки ртутного столбика надо отметить температуру начала кристаллизации льда tc Обозначим температуру замерзания чистой воды t0, тогда раз - Криоскоп. [32]
Кремневая кислота не находится при этом в состоянии истинного раствора. Если раствор выпарить, то остается аморфная желатинообразная макса, которая лишь слабо растворяется в воде. Точки кипения и замерзания таких растворов кремневой кислоты не отличаются значительно от точек кипения и замерзания чистой воды. [33]
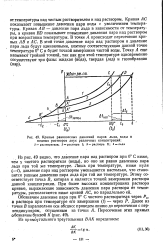 |
Кривые равновесных давлений паров льда, воды а. [34] |
Кривая АС показывает повышение давления пара воды с увеличением температуры. Кривая АВ - давление пара льда в зависимости от температуры, а кривая BD показывает повышение давления пара над раствором при возрастании температуры. В точке А происходит пересечение кривых АВ и АС. В этой точке давление пара над раствором и давление пара льда будут одинаковыми, поэтому соответствующая данной точке температура О С и будет точкой замерзания чистой воды. [35]
Рассмотрим конденсированные двухкомпонентные системы, в которых тиердые фазы компонентов взаимно нерастворимы. Тогда возможны три фазы: твердый компонент I, твердый компонент II п жидкая фаза. Так как / 3 - р, то фазовая диаграмма должна содержать инвариантную точку, соответствующую существованию трех фаз. На рис. 6 изображены температуры плавления и замерзания системы нитрат серебра - вода при атмосферном давлении [6] как функции мольной доли соли. Точка 0 на шкале t соответствует температуре замерзания чистой воды, а точка М - температуре плавления ромбической модификации нитрата серебра. Кривая ОЕ показывает, как понижается температура замерзания воды при добавлении нитрата серебра. Кривая ME показывает влияние добавок поди на температуру затвердевания нитрата серебра. Отношение числа молей воды к числу молей соли в эвтектической точке, равное 10 81 но отвечает составу какого-либо простого соединения. Твердая фаза, существующая в эвтектической точке, при рассматривании под микроскопом оказывается просто смесью, а не твердым раствором. Эвтектическая точка в конденсированной диухкомионентшш системе, содержащей воду, часто называется криогидратшш точкой. При охлаждении ненасыщенного раствора, в котором мольная доля соли меньше 0 084Ь8, первые пристал появляющиеся при пересечении линии ОЕ, оказываются льдом. Лапьнепшее охлаждение приводит к выпадению кристаллической соли. Попасть ОЛЕ соответствует системе лед плюс насыщенный раствор. При охлаждении раствора, который богаче солью, чем эвтектическая смесь, из раствора вначале выпадают кристаллы нитрата серебра. [36]
Рассмотрим простейший вывод этого закона. На рис. 27 показана диаграмма, выражающая зависимость давления насыщенного пара от температуры над чистым растворителем и над раствором. Кривая АС показывает повышение давления пара воды с увеличением температуры, кривая АВ - давление пара льда в зависимости от температуры, а кривая ВО - повышение давления пара над раствором при возрастании температуры. В точке А происходит пересечение кривых АВ и АС. В этой точке давление пара над раствором и давление пара льда одинаковы, поэтому соответствующая данной точке температура 273 16 К есть точка замерзания чистой воды. [37]
Страницы: 1 2 3