Эффективный заряд - атом
Cтраница 2
Эффективный заряд атома выражен в долях заряда одно-о электрона и вычислен из экспериментальных значений дипольного момента и длины связи. [16]
Понятию эффективный заряд атомов, связанных преимущественно ковалентной связью, присуща неопределенность. Действительно, зарядом атома именуется заряд, находящийся внутри объема, окружающего атом. Для ионного кристалла это определение вполне приемлемо, потому что электронная плотность между соседними ионами очень мала, и объем, занимаемый каждым ионом, можно определить достаточно точно. [17]
 |
Эффективные заряды е атомов соединений ArIBVI. [18] |
Понятию эффективный заряд атомов, связанных преимущественно ковалентной связью, присуща неопределенность. Действительно, зарядом атома именуется заряд, находящийся внутри объема, окружающего атом. [19]
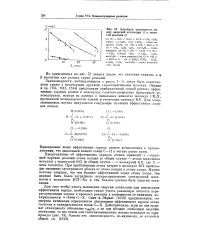 |
Линейная зависимость между энергией активации Е и теплотой реакции Q. [20] |
Приведенные выше эффективные заряды атомов вычислялись в предположении, что дипольный момент связи С - Н в метане равен нулю. [21]
Изменения эффективных зарядов атомов, каким бы способом их не определять, дают в некотором смысле суммарную характеристику перераспределения электронной плотности при образовании Н - связи. Наиболее полное и детальное представление об изменении электронной структуры молекул может дать анализ изменения электронной плотности Ар ( г) в различных точках занимаемого ими объема. [22]
 |
Влияние дипольного момента свя - Л У.| Релаксация р-орбитали. а атслиии, ороит. хль.| Изменение энергии АО при релаксации. а - сжатие орбитали. б - расширение орбитали. [23] |
Возникновение эффективных зарядов атомов ковалентной химической связи приводит к их электростатическому взаимодействию. Поскольку во многих случаях эффективные заряды атомов имеют противоположные знаки, то электростатическое притяжение противоположно заряженных атомов ведет к упрочнению химической связи. [24]
Под эффективным зарядом атома понимают суммарный заряд атома, который возникает в непосредственной близости от ядра после образования химической связи. Например, в молекуле НС1 связующее электронное облако смещено в сторону более электроотрицательного атома хлора. В результате на атоме хлора возникает отрицательный заряд ( 6ci - 0 2 заряда электрона), а на атоме водорода равный по величине положительный заряд ( 6ц 0 2); эти заряды называют эффективными зарядами атомов в молекулах. Эффективные заряды, как правило, значительно меньше степеней окисления. [25]
Под эффективным зарядом атома понимают суммарный заряд атома, который возникает в непосредственной близости от ядра после образования химической связи. Например, в молекуле НС1 связующее электронное облако смещено в сторону более электроотрицательного атома хлора. Эти заряды называют эффективными зарядами атомов в молекулах, они, как правило, значительно меньше степеней окисления. [26]
Объективные значения эффективных зарядов атомов в молекулах были получены экспериментально методами рентгеновской [233] и инфракрасной [234] спектроскопии. [27]
Для нахождения эффективных зарядов атомов А и В в кристаллах АВ необходимо сопоставить ОС А. [28]
 |
Перекрывание s - и р-орбиталей. Интеграл перекрывания равен нулю. [29] |
Для оценки эффективного заряда атома Мп учтем, что нижележащие орбитали Мп полностью заполнены и содержат в сумме 18 электронов ( Is2 2s2pe3s2pe), a 4d и вышележащие - пустые. Малое 7мп указывает на значительную ковалентность связей в системе. [30]
Страницы: 1 2 3 4 5