Значение - потенциал - электрод
Cтраница 1
Значение потенциала электрода в градуировочном растворе должно равняться среднему арифметическому из 3 - 5 измерений. Проверку градуировочного графика проводят в процессе анализа проб на трех растворах в диапазоне концентраций анализируемых проб. [1]
Значение потенциала электрода p / s при поляризующем токе, равном половине предельного тока, называется потенциалом полуволны, а уравнение (9.29) - уравнением полярографической волны. [2]
Значение потенциала электрода qi / 2 при поляризующем токе, равном половине предельного тока, называется потенциалом полуволны, а уравнение (9.29) - уравнением полярографической волны. [3]
Выбор значения потенциала электрода, как было сказано выше, в § 4 гл. VIII, должен основываться на анализе f - ф-кри-вых для данного процесса и отвечать условиям 100 % - ного выхода по току электрогенерируемого реагента. [4]
Для измерения значения потенциала электрода в контрольных растворах составляется цепь: Ag AgCl KCLac Солевой мостик Исследуемый раствор ( Электрод ЭМ-К-01. Солевой мостик в цепи необходим для предотвращения прямого контакта анализируемого раствора с полуэлементом электрода сравнения, работающего по принципу истечения насыщенного раствора хлорида калия. [5]
Приведенные примеры наглядно иллюстрируют значение потенциала электрода при проведении электрохимического органического синтеза. [6]
 |
Схема электрохимического коррозионного процесса. [7] |
Это перетекание электронов выравнивает значения потенциалов замкнутых электродов. Если бы при этом электродные процессы ( анодный на аноде и катодный на катоде) не протекали, потенциалы электродов сравнялись бы и наступила бы полная поляризация. Отсюда, в частности, происходит и название ионов и молекул раствора, обеспечивающих протекание катодного процесса - деполяризаторы. [8]
Таким образом, разброс значений потенциала электрода относительно грунта при значительном напряжении между электродами ( 50 - 100 В) зависит от значения последнего. [9]
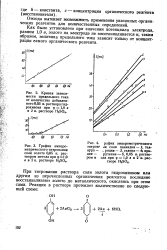 |
График амперо-метрического титрования соли золота 0 05 н. раствором метола при 91 0 в в 2 н. растворе HgSO. [10] |
Как было установлено при значении потенциала электрода, равном 1 0 в, золото на электроде не восстанавливается, таким образом, величина предельного тока зависит только от концент рации самого органического реагента. [11]
Подставляя приведенные выше уравнения для значений потенциала соответствующего электрода ( водородного или хингидронного) и каломельного полуэлемента, получаем расчетные формулы, приведенные ниже. [12]
Подставляя приведенные выше уравнения для значений потенциала соответствующего электрода ( водородного или хингидронного) и каломельного полуэлемента, получаем расчетные формулы, приведенные ниже. [13]
При одном и том же значении потенциала электрода скорость и даже направление электродных процессов могут существенным образом зависеть от адсорбции компонентов раствора. Так, сильное влияние на кинетику и механизм превращений органических веществ на окисленном электроде оказывает природа аниона и катиона фона. Так, при окислении на Pt-электроде фенилук-сусной кислоты в метанольно-пиридиновых растворах добавление С1О4 - - анионов приводит к резкому снижению выхода димера в области потенциалов электросинтеза Кольбе, а основным продуктом становится бензилметиловый эфир. Специфическая адсорбция катионов положительно влияет на выход димеров по Кольбе и Брауну-Уокеру. Карбонат - и бикарбонат-анионы, с одной стороны, и сульфат -, перхлорат - и нитрат-анионы - с другой, по-разному влияют на селективность анодных превращений ацетата в щелочных водных растворах: в частности, первые из них увеличивают, а вторые практически не изменяют выход спирта. [14]
Следует напомнить, что знак и значение потенциала электрода в гальваническом элементе не зависят от схематической записи происходящего в элементе процесса, в то время как потенциал полуреакции, вычисленный по уравнению Нернста, является термодинамической величиной и зависит от того, в каком направлении написана полуреак-ция. При построении кривой редокс титрования потенциал интересующей нас полуреакции, если она записана как реакция восстановления, всегда идентичен по знаку и значению потенциалу индикаторного электрода относительно стандартного водородного электрода. Поэтому при построении кривой титрования мы будем применять уравнение Нернста специфично к полуреакции, написанной как процесс восстановления. [15]
Страницы: 1 2 3 4