Значение - потенциал - электрод
Cтраница 2
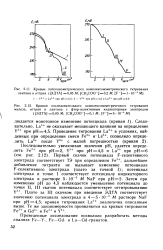 |
Кривые потенциометрического комплексонометрического титрования лантана и иттрия ( [ ЭДТА ] 0 05 М. [ СН3СОО - ] 0 2 М, [ F - ] 1 10 - 4 M. [16] |
Плато за III скачком при введении ЭДТА соответствует значению потенциала электрода в 4 - 5 - Ю 5 М растворе NaF при рН 4 5; кривая титрования La3 аналогична описанным выше. [17]
Титруют раствором нитрата лантана при перемешивании магнитной мешалкой до значения потенциала фтор-селективного электрода в модельном растворе. По мере приближения потенциала электрода к этому значению ( начиная со 160 мВ) титрант добавляют медленно, по каплям, дожидаясь установления его постоянного значения. [18]
Скорость электрохимической реакции на электроде при одном и том же значении потенциала электрода может меняться в зависимости от многих факторов: концентрации и температуры раствора, условий перемешивания раствора, материала электрода, наличия адсорбции на электроде каких-либо компонентов из раствора и других факторов. [19]
 |
Анодная реакция.| Катодная реакция. [20] |
Кривые if ( E) показывают скорость электрохимической реакции при каждом значении потенциала электрода. [21]
Ограничения использования амперостатической кулономет-рии обусловлены трудностью поддержания постоянным при заданной силе тока значения потенциала электрода, при котором окисляется или ( восстанавливается) только определяемое вещество. В то же время амперостатическая методика привлекательна возможностью простого определения количества электричества пошедшего на электролиз определяемого вещества. [22]
Ограничения использования амперостатической кулономет-рии обусловлены трудностью поддержания постоянным при заданной силе тока значения потенциала электрода, при котором окисляется или ( восстанавливается) только определяемое вещет ство. В то же время амперостатическая методика привлекательна возможностью простого определения количества электричества пошедшего на электролиз определяемого вещества. [23]
Ограничения использования амперостатической кулономет-рии обусловлены трудностью поддержания постоянным при заданной силе тока значения потенциала электрода, при котором окисляется или ( восстанавливается) только определяемое вещество. В то же время амперостатическая методика привлекательна возможностью простого определения количества электричества пошедшего на электролиз определяемого вещества. [24]
Появление новой волны дальнейшего восстановления органического соединения оказывается возможным при достижении таких значений потенциала электрода, которые соответствуют пику адсорбции - десорбции на кривых дифференциальной емкости, измеренных в растворе соответствующего ПАВ. Таким образом, торможение реакции (7.17) снимается в результате десорбции с поверхности электрода основного количества ПАВ, что в свою очередь создает условия для протекания последующих электрохимических стадий реакции. Эффект, вызываемый ПАВ в области потенциалов их адсорбции, указывает на то, что реакция протонирования анион-радикалов в значительной мере локализуется на поверхности электрода. [26]
Однако сдвиг потенциала от обратимой величины является здесь следствием чисто концентрационных изменений и поэтому значение потенциала электрода под током ei можно рассматривать как новое значение равновесного потенциала к г, отличающееся от исходного вт только тем, что оно отвечает теперь другим значениям концентрации или, точнее, активностей участников электродной реакции. [27]
Однако сдвиг потенциала от обратимой величины является здесь следствием чисто концентрационных изменений и поэтому значение потенциала электрода под током S ] можно рассматривать как новое значение равновесного потенциала S, отличающееся от исходного & только тем, что оно отвечает теперь другим значениям концентрации или, точнее, активности участников электродной реакции. [28]
Таким образом, при известном значении рН среды можно рассчитать теоретически возможное для заданных условий значение потенциала электрода и, сопоставляя его с экспериментальным значением, строго контролировать исходное стандартное состояние катализатора. [29]
Поскольку в разных сериях опытов возможно изменение в составе промежуточных растворов, лучше использовать эти значения потенциалов электродов сравнения для определения рН ряда хорошо воспроизводимых буферных растворов ( ср. [30]
Страницы: 1 2 3 4
