Аналог - азот
Cтраница 2
Хотя по числу валентных электронов и по их состоянию фосфор - аналог азота Is22s22p63s23px3py3p2, имеющиеся у него З - орбитали, делают химию фосфора глубоко отличной от химии азота. Валентные состояния атомов фосфора и азота различны. Стабильность азота осуществляется сочетанием s - и р-орбиталей и наличием sp -, sp2 - и 5р3 - гнбридизаций. [16]
Фосфор Р ( ls22s22 63s23 / 3) по числу валентных элементов является аналогом азота. Однако как элемент 3-го периода он существенно отличается от азота - элемента 2-го периода. [17]
Фосфор Р ( Is2 2s2 2p6 3s2 Зр3) по числу валентных электронов является аналогом азота. Однако как элемент 3-го периода он существенно отличается от азота - элемента 2-го периода. Это отличие состоит в том, что у фосфора больше размер атома, меньше энергия ионизации, большее сродство к электрону и большая поляризуемость атома, чем у азота. [18]
Фосфор расположен в 3 - м периоде ( V группа) Периодической системы элементов и формально является аналогом азота. Однако соединения азота и фосфорорганические соединения значительно различаются по свойствам. Фосфор менее электроотрицателен, чем азот, и образует с кислородом и галогенами более прочные связи. Напротив, соединения фосфора с водородом менее устойчивы. Фосфор обладает малой склонностью к образованию двойных связей. Используя вакантные Зс / - орбитали, он склонен к образованию соединений, в которых является пентакоординированным. [19]
Характеризуя главную подгруппу V группы, Менделеев называет завершающей элемент этой группы - висмут ( Bi 208) тяжелейшим аналогом азота и фосфора. Как и в других группах, основные, металлические свойства с возрастанием атомного веса и здесь возросли - констатирует великий химик. [20]
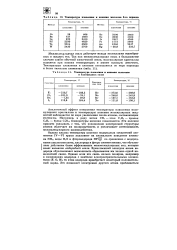 |
Температура плавления и кипения галогенов и благородных газов. [21] |
Однако анализ температур кипения водородных соединений элементов IV-VI групп указывает на аномальное поведение аммиака NH3, воды Н2О и фтороводорода HF по сравнению с водородными аналогами азота, кислорода и фтора соответственно, что обусловлено действием более эффективных межмолекулярных сил, которые носят название водородной связи. Единственный электрон атома водорода обусловливает возможность образования им только одной ко-валентной связи. Однако если эта связь сильно полярна, например в соединениях водорода с наиболее электроотрицательными элементами ( F, О, N), то атом водорода приобретает некоторый положительный заряд. [22]
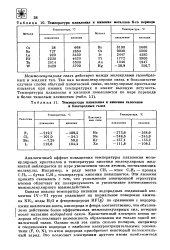 |
Температура плавления и кипения галогенов и благородных газов. [23] |
Однако анализ температур кипения водородных соединений элементов IV-VI групп указывает на аномальное поведение аммиака МНз, воды ШО и фтороводорода НР ( в) по сравнению с водородными аналогами азота, кислорода и фтора соответственно, что обусловлено действием более эффективных межмолекулярных сил, которые носят название водородной связи. Единственный электрон атома водорода обусловливает возможность образования им только одной ко-валентной связи. Однако если эта связь сильно полярна, например в соединениях водорода с наиболее электроотрицательными элементами ( F, О, N), то атом водорода приобретает некоторый положительный заряд. [24]
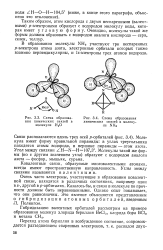 |
Схема образования химических связей в молекуле Н2О.| Схема образования химических связей в молекуле МН3. [25] |
Молекула имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, в вершине пирамиды - атом азота. Молекулы такой же формы ( но с другим значением угла) образуют с водородом аналоги азота - фосфор, мышьяк, сурьма. [26]
В образовании молекулы МНз участвуют три неспаренных р-электрона атома азота, электронные орбитали которых также взаимно перпендикулярны, и ls - электроны трех атомов водорода. Молекулы такой же формы ( но с другим значением угла) образуют с водородом аналоги азота - с [ хсфор, мышьяк, сурьма. [27]
Атомы элементов главной подгруппы V группы периодической системы имеют во внешних электронных оболочках 5 электронов. Однако если предположение о высшей положительной валентности, равной 5, в полной мере обосновано для аналогов азота - фосфора, мышьяка - сурьмы и висмута, то для самого азота оно может быть принято лишь условно. [28]
Существенным недостатком обычного варианта периодической системы являлось то обстоятельство, что в нем не была выявлена связь между типическими элементами каждой группы и членами ее левой и правой подгрупп. Так, из системы вытекало, что, например, в V группе сурьма является аналогом мышьяка, ниобий - аналогом ванадия и фосфор - аналогом азота. Оставалось, однако, неясным, в каком отношении к фосфору стоят ванадий и мышьяк. [29]
Существенным недостатком обычного варианта периодической системы являлось то обстоя-тельство, что в нем не была выявлена связь между типическими элементами каждой группы и членами ее левой и правой подгрупп. Так, из системы вытекало, что, например, в V группе сурьма является аналогом мышьяка, ниобий - аналогом ванадия и фосфор - аналогом азота. [30]
Страницы: 1 2 3