Более отрицательное значение - потенциал
Cтраница 3
Как видно из этого рисунка, полярографирование на фоне N ( C2H5) 4l значительно улучшает форму волны, в первую очередь, за счет смещения начала восстановления фонового электролита к более отрицательным значениям потенциалов. Обращает на себя внимание резкое возрастание тока при восстановлении иона тетра-этиламмония в диметилформамиде. Что касается изменений Е / 2 лри введении в молекулу стирола алкильных заместителей, то они соответствуют электронодонорному действию последних, вызывающему повышение электронной плотности на винильной группе. При этом наблюдается заметное различие в поведении три - и тетразамещенных стиролов, имеющих заместители в разных положениях по отношению к винильной группе. Видно, что мономеры, у которых метальные группы находятся в соседних с винильной группой положениях восстанавливаются труднее, чем те, у которых хотя бы один из атомов водорода, находящихся в орто-положении, не замещен на метильную группу. Это связано, в первую очередь, со стерическим влиянием двух соседних метальных групп, которые выводят винильную группу из плоскости бензольного кольца, что несколько нарушает сопряжение и, как следствие, затрудняет ее полярографическое восстановление. [31]
Полярографический метод находит применение для изучения комплексных соединений благодаря тому, что потенциал полуволны разряжающегося комплексного иона резко отличается от потенциала полуволны простого иона; наблюдается смещение р1 / 2 в сторону более отрицательных значений потенциалов. [32]
Обращает на себя внимание также постоянство предельного тока для эфиров во всей области рН ( вплоть до рН 12 7), в то время как при полярографическом восстановлении альдегидов и кетонов в сильнощелочных средах обычно наблюдается снижение высоты волны ( за счет снижения концентрации ионов Н, обеспечивающих предварительную протонизацию восстанавливающихся частиц) и появление новой волны при более отрицательных значениях потенциалов. Кроме того, близкие между собой значения разностей потенциалов полуволн в случае стирола и а-метилсти-рола ( A. [33]
Последовательное расположение металлов по значению их стандартных потенциалов называется электрохимическим рядом напряжений. Более отрицательные значения потенциалов соответствуют большей способности металлов вступать в химические реакции. Чем дальше один от другого в ряду напряжений расположены металлы, тем большую ЭДС можно от них получить. При замыкании внешней цепи электродов возникает электрический ток. На этом основан принцип действия химических источников электрической энергии - гальванических элементов. [34]
На сплавах с более отрицательными значениями потенциала ( от - 0 7 до - 1 0 В) питтинг практически не образовывался. Причина такого поведения сплавов становится понятной, если сопоставить указанные области коррозионных потенциалов со значением критического потенциала питтинго-образования в 3 % растворе NaCl, которое составляет - 0 45 В ( см. разд. Контакт образцов сплавов, склонных к питтингу, с пластинами активного алюминиевого сплава ( см. разд. В в основном успешно предотвращал образование питтинга в течение всего периода испытаний. Результаты этих испытаний в реальных условиях подтверждают предположение, что в отсутствие щелей алюминий и его сплавы при потенциалах ниже критического значения не подвергаются питтинговой коррозии. [35]
 |
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ В 3 % - ном ВОДНОМ РАСТВОРЕ NaCl ( ПО АКИМОВУ. [36] |
Основной причиной электрохимической коррозии является термодинамическая неустойчивость металла в данном электролите, величина которой определяется величиной стандартного электродного потенциала. Как правило, чем более отрицательное значение потенциала, тем менее термодинамически устойчив данный металл. Поскольку экспериментально и теоретически до сих пор не удается установить абсолютные значения потенциалов, то их определяют по отношению к стандартному водородному электроду, потенциал которого условно принимается равным нулю во всех средах и при всех температурах. Электродвижущую силу гальванического элемента, состоящего из стандартного водородного электрода и исследуемого электрода в растворе электролита, называют электродным потенциалом. [37]
 |
Подпрограммы некоторых органических перекисей ( фон-0 02 н. раствор. НС1. [38] |
Потенциал полуволны зависит от природы перекиси и становится более положительным с увеличением алкильных групп. В щелочных растворах получаются более отрицательные значения потенциалов полуволн. В этих растворах перекиси разрушаются при добавлении солей титана. [39]
На рис. 40 слева изображены парциальные кинетические кривые электрохимических процессов, протекающих с участием ионов металла и Н - ионов на сложном электроде. Вверх по оси ординат отложены более отрицательные значения потенциала. Поэтому равновесный потенциал в системе металл - ионы металла располагается выше, а равновесный потенциал во второй окислительно-восстановительной системе, в которой участвуют водород и Н - ионы, находится несколько ниже. Налево от оси ординат отложены значения скорости анодного процесса ионизации металла и водорода, направо - скорость катодных процессов разряда ионов металла и вода-рода. Сплошные линии, проведенные через точки равновесных потенциалов в обеих системах изображают поляризационные кривые, характеризующие зависимость потенциала металла и водородного электрода от внешнего тока. [40]
Установлено [4], что поляризация при анодном растворении кадмия, олова и сплавов кадмия и олова, содержащих 25 и 50 % Sn, различна. Растворение кадмия протекает при значительно более отрицательных значениях потенциала, чем анодное растворение олова. При плотности тока 0 4 а / дм анодное растворение кадмия и олова протекает без пассивации металлов. Характер анодной поляризации значительно меняется с изменением концентрации бор-фтористоводородной кислоты в электролите. При содержании в электролите 27 Г / л HBF4 анодное растворение сплава Cd-Sn, содержащего 25 % олова, происходит с преимущественным переходом в электролит кадмия. Для перехода в электролит обоих компонентов сплава необходимо увеличение концентрации борфтористоводород-ной кислоты. [41]
Положение максимума на дифференциальных кривых не всегда соответствует потенциалу полуволны данного вещества на обычной подпрограмме. Как правило, он несколько сдвинут в сторону более отрицательных значений потенциалов. Сдвиг этот значительно возрастает с увеличением. [42]
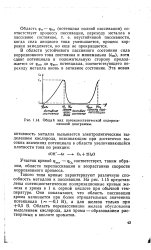 |
Общий вид потенциостатической поляризационной диаграммы. [43] |
Такого типа кривые характеризуют различную способность металлов к пассивации. Они показывают, что область пассивации хрома начинается при более отрицательных значениях потенциала ( - - 0 1 В), а для железа только при 0 5 В. [44]
 |
Общий вид потенциостатической поляризационной диаграммы. [45] |
Страницы: 1 2 3 4 5