Рениевый ангидрид
Cтраница 2
При анализе производных карбонила рения, содержащих группу - SO3K, рениевый ангидрид вытесняет из солей оксиды серы. [16]
Резорцин, бромирование 562 Рени металл 225, 229 Рениевая кислота, экстракция 956 Рениевый ангидрид, отгонка 956 Рений 54, 956 ел. [17]
В ряду ангидридов Та2О5, WOs, Re2O7 наблюдается возрастание сродства к воде; кислота, отвечающая рениевому ангидриду, оказывается наиболее прочной кислотой и вместе с тем и наибольшей силы. Следовало бы ожидать отсюда, что высший окисел осмия OsO4, как элемента, следующего за рением, будет обладать еще большим сродством к воде и ему будет отвечать кислота чрезвычайно сильная. Но в действительности четырехокиси рутения и осмия оказываются практически безразличными окислами. Этот факт легко объясняется с точки зрения правила постоянства координационного числа. [18]
В ряду ангидридов Та2О5, W03, Re2O7 наблюдается возрастание сродства к воде; кислота, отвечающая рениевому ангидриду, оказывается наиболее прочной кислотой и вместе с тем и набольшей силы. Следовало бы ожидать отсюда, что высший окисел осмия OsO4 как элемента, следующего за рением, будет обладать еще большим сродством к воде и ему будет отвечать кислота чрезвычайно сильная. Но в действительности четырехокиси рутения и осмия оказываются практически безразличными окислами. Этот факт легко объясняется с точки зрения правила постоянного координационного числа. [19]
Рений образует несколько оксидов, из которых наиболее стойким и характерным для рения является оксид рения ( VII), или рениевый ангидрид, I O. При взаимодействии его с водой получается бесцветный раствор рениевой кислоты HReO - t, соли которой называются перренатами. В отличие от марганцовой кислоты и ее солей, окислительные свойства для рениевой кислоты и перренатов не характерны. [20]
Растворы рениевой кислоты концентрируются выпариванием, но получить кислоту в свободном состоянии не удается, так как происходит диссоциация с образованием рениевого ангидрида. [21]
Из окислов шест и валентных Мп и Re известна только трехокись рения, которая может быть получена по реакции Re2O -, CO CO2 2ReO3 слабым нагреванием рениевого ангидрида в атмосфере окиси углерода. [22]
С кислородом, как и марганец, образует ряд оксидов: ReO - окись, Re203 - полутораокись, ReO2 - двуокись, Re03 - трех-окись и Re207 - рениевый ангидрид. ReO и Re203 обладают основными свойствами, Re02 - амфотерными, a Re03 и Re207 - кислотными. Оксиды ReO, Re203, Re02 и в некоторой степени Re03 обладают восстановительными свойствами. [23]
Молибденовые концентраты при переработке на молибдат кальция, молибдат аммония или ферромолибден подвергаются окислительному обжигу. Благодаря высокой летучести рениевого ангидрида ( рис. 163) большая часть рения при обжиге улетучивается. [24]
 |
Прибор для получения рениевого ангидрида. [25] |
Этого осложнения можно избежать, тщательно следя за ходом окисления, проводимого в закрытой системе. Получение небольших количеств рениевого ангидрида проходит довольно гладко. [26]
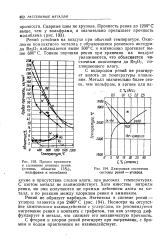 |
Предел прочности.| Диаграмма состояния системы рений - углерод. [27] |
Рений устойчив на воздухе при обычной температуре. Окисление компактного металла с образованием рениевого ангидрида Re2O7 наблюдается выше 300 С и интенсивно протекает выше 600 С. [28]
Ее получают растворением рениевого ангидрида в воде. [29]
Осадок сульфидов обжигают с небольшим количеством соды при 350 С с целью удаления элементарной серы и тяжелых металлов. Они образуют сульфаты, растворимые в воде. Раствор, в который переходит часть рения, возвращается в процесс. Рениевый ангидрид выщелачивают водой. Так как при обжиге частично образуются перренат таллия и другие малорастворимые соединения рения, остаток выщелачивают азотной кислотой и бромной водой. Соединенные растворы очищают от таллия и других тяжелых металлов сернистым натрием. [30]
Страницы: 1 2 3