Избыток - тиосульфат
Cтраница 2
Баталии [18] прибавляет к испытуемому раствору избыток тиосульфата, отфильтровывает образовавшийся осадок и прибавляет к кристаллику иодида калия каплю фильтрата на полоске фильтровальной бумаги. В присутствии висмута образуется черный или оранжевый осадок. Открываемый минимум, предельное разбавление и предельные отношения не установлены. [16]
Приблизительно к 20 мл 0 1 М раствора уксусной кислоты добавляют 1 г KI, б мл 3 % - ного раствора КЮ3 и 25 мл 0 1 М раствора тиосульфата. Через 15 - 30 мин титруют избыток тиосульфата стандартным раствором иода. [17]
По этой схеме 1 молекула Hg ( CNO) 2 должна дать 2 мол. На самом же деле образуются 4 молекулы щелочного характера при условии избытка тиосульфата ( минимум - 4 молекулы) за счет каких-то нестойких продуктов ( производных тиосульфата), так как щелочность их быстро падает. Для уменьшения распада, по Р h i 11 i p y, благоприятное влияние имеет концентрация тиосульфата. Чем она больше, тем медленнее происходит распад. Это тем выгоднее, что процесс растворения Hg ( CNO) 2 идет быстрее. [18]
К 70 мл буферного раствора прибавляют 1 г иодида калия и 10 мл титрованного раствора тиосульфата. Затем пропускают анализируемый газ со скоростью 3 л в минуту и титруют избыток тиосульфата раствором иода. [19]
К 70 мл буферного раствора прибавляют 1 г иодида калия и 10 мл титрованного раствора тиосульфата. Затем пропускают анализируемый газ со скоростью 3 л в минуту и титруют избыток тиосульфата раствором иода. [20]
К 70 жл буферного раствора прибавляют 1 г иодида калия и 10 мл титрованного раствора тиосульфата. Затем пропускают анализируемый газ со скоростью 3 л в минуту и титруют избыток тиосульфата раствором иода. [21]
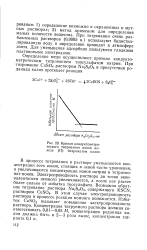 |
Кривая кондуктометри-ческого титрования ионов железа ( II бихроматом калия. [22] |
В процессе титрования в растворе уменьшаются концентрации всех ионов, стоящих в левой части уравнения, и увеличиваются концентрации ионов натрия и тетратио-нат-ионов. Электропроводность раствора до точки эквивалентности немного увеличивается, а после нее растет более сильно от избытка тиосульфата. В этом случае электропроводность раствора в процессе реакции немного понижается. Избыток CuSO4 вызывает повышение электропроводности раствора. [23]
Фильтрат выпаривают в платиновой чашке до выделения паров серной кислоты. По охлаждении разбавляют водой, нагревают до растворения солей, затем выделяют медь тиосульфатом, окисляют железо и избыток тиосульфата кипячением с азотной кислотой, а затем определяют никель гравиметрическим или фотометрическим методом. [24]
По истечении указанного премс-ни избыток бисульфита связывают 0 1 н раствором иода, добавляя его каплями ( в присутствии крахмала) до появления синего окрашивания. Для удаления избытка иода прилипают по каплям 0 1 н растпор тиосульфата натрия ( гипосульфита) до обесцвечивания содержимого колбы, после чего прибавляют ( также по каплям) 0 01 н раствор иода ( для связывания избытка тиосульфата) до появления синего окрашивания от последней капли раствора. [25]
Налить в стакан раствор сульфата меди, прибавить иодид калия. Затем, прилив в стакан немного раствора крахмала, прибавлять тиосульфат натрия до исчезновения синей окраски. Избыток тиосульфата прибавлять не следует. [26]
Налить в стакан раствор сульфата меди, прибавить иодид калия. Теперь, прилив в стакан немного раствора крахмала, прибавлять тиосульфат натрия до исчезновения синей окраски. Избыток тиосульфата прибавлять не следует. [27]
К раствору хлорида золота прибавляют йодистый калий до полного растворения первоначально выделившегося AuJ. Затем приливают несколько миллилитров раствора крахмала и 0 001 N раствор Na2S2O3 до обесцвечивания раствора. После этого титруют избыток тиосульфата 0 001 N раствором иода до розовой окраски, возникающей в точке эквивалентности. [28]
Хорошее схождение этих чисел в опытах I-III с найденными числами миллимолей политионовых кислот, а также с количествам взятого сульфида, находится в полном соответствии с уравнением ( 4) и подтверждает правильность последнего. Для опытов IV и V такого схождения нельзя и ожидать, так как здесь, вследствие наличия избытка одного из реагирующих веществ, должны были в значительной-мере иметь место побочные реакции. Например, в случае избытка тиосульфата ( опыт IV) часть последнего, повидимому, превращается в политионовые кислоты без участия сероводорода. [29]
В присутствии метанола использовать крахмал в качестве индикатора не рекомендуется и титрование следует проводить до исчезновения окраски свободного иода. По окончании титрования через несколько минут снова может появиться слабая окраска иода; за конечную точку титрования следует принять момент первоначального исчезновения окраски. Если проба большая, то избыток тиосульфата при титровании будет сравнительно невелик, и окраска иода возобновляется быстро. При малых пробах избыток реактива сравнительно велик и окраска появляется медленнее. [30]
Страницы: 1 2 3