Измерение - скорость - процесс
Cтраница 1
Измерения скорости процесса приводят к выводу, что число частиц, образующих активный ансамбль, обычно очень невелико. Так, для реакции синтеза аммиака, при применении железа в качестве катализатора, активный ансамбль состоит из трех атомов железа. [1]
 |
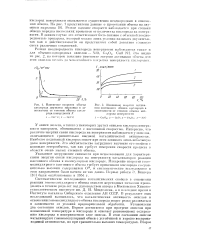
Изменение прямого ( а и обратного ( б сопротивлений запорного слоя выпрямителя Cu2O - TiO2 со временем. i - время ( в минутах. [2] |
Измерения скорости процесса, если его приписывать перемещению ионов в запорном слое, позволяют определить подвижность ионов. [3]
Если галогенирование проводят при очень малой концентрации галогена, то из-за малой эффективной скорости галогенирова-ния ( v k3 [ енол ] [ Х2 ]) становится возможным измерение скорости процесса галогенирования. Сначала под действием красного фосфора ( через стадию РХ3) образуется соответствующий галогенангидрид, карбонильная группа которого очень реакционноспособна ( см. разд. [4]
Первая реакция изучена также Хейхестом и Сагденом [159, 160], которые, используя ту же методику, получили сравнимый результат: 1 10 8см3 / ( молек-с); измерения скоростей процессов производились по увеличению скорости расходования ионов НзО в пламени с добавками металлов. Пэдли и Сагден [161] оценили константу скорости рекомбинации в присутствии свинца и получили значение 3 - 10 - 9, которое хорошо согласуется с более точным результатом, приведенным выше. [5]
При изучении скорости адсорбции и адсорбционного равновесия задача сводится всегда к измерению количества адсорбированного газа или пара. При измерениях скорости процесса адсорбированное количество является функцией времени, при измерениях равновесия оно будет функцией температуры и давления. Измерения могут быть прямыми и косвенными. Измерение называют прямым, если непосредственно измеряется объем или масса адсорбированного вещества, и косвенным - если измеряется какое-нибудь другое физическое свойство адсорбированной фазы, функциональная связь которого с количеством адсорбированного вещества известна. [6]
Константа скорости k изучена многими авторами. Помимо работы Грина и Сагдена, существует много масс-спектрометри-ческих измерений скорости процесса электронно-ионной рекомбинации в пламенах. [7]
Перед началом работ производится калибровка оси объемов водорода по измерению скорости процесса с точно известным количеством выделяющегося водорода. [8]
Спектрофотометры Spekord 71 - IR и 72 - IR работают в инфракрасной области спектра. Применяются для изучения структуры соединений, исследований на чистоту, изучения процессов полимеризации, измерения скорости процессов кинетических реакций. Источником излучения служит керамический стержень, нагреваемый до 1200 С с помощью вставленной в него платино-родиевой спирали. Спектрометр Spekord 75 IR обеспечивает измерение в интервале волновых чисел от 4000 до 400 см-1. Является двойным дифракционно-призменным монохроматором с автоматической регистрацией. Применяют для анализа твердых, жидких и газообразных веществ, идентификации молекулярных групп, изучения соотношения связей, выяснения пространственной структуры соединений, испытания на чистоту. Источником излучения является инфракрасная горелка, охлаждаемая воздухом. [9]
Фабри - Перо; эти методы также описаны в книге. Использование этой экспериментальной техники позволяет получить новую информацию о размерах, форме и движении полимерных молекул в растворах и в твердом состоянии вещества. Разумеется, и само по себе измерение скорости процесса диффузии является важным методом структурного анализа, который также обсуждается в книге. [10]
Ионика и электродика исследуют как равновесные, так и неравновесные явления и процессы. Изучение свойств ионных систем в равновесных условиях позволяет развить представления о строении растворов и расплавов электролитов и твердых электролитов, тогда как измерения в неравновесных условиях дают сведения об электропроводности ионных систем, а также о кинетике ионных реакций. В электро-дике исследованием равновесий на границе электрод - раствор ( расплав) занимается электрохимическая термодинамика. Измерения скоростей процессов на этой границе и выяснение закономерностей, которым они подчиняются, составляют объект кинетики электродных процессов или электрохимической кинетики. В настоящее время кинетика электродных процессов представляет собой одно из наиболее быстро развивающихся направлений теоретической электрохимии. [11]
Ионика и электродика исследуют как равновесные, так и неравновесные явления и процессы. Изучение свойств ионных систем в равновесных условиях позволяет развить представления о строении растворов и расплавов электролитов и твердых электролитов, тогда как измерения в неравновесных условиях дают сведения об электропроводности ионных систем. В электродике исследованием равновесий на границе электрод - раствор ( расплав) занимается электрохимическая термодинамика. Измерения скоростей процессов на этой границе и выяснение закономерностей, которым они подчиняются, являются объектом кинетики электродных процессов или электрохимической кинетики. В настоящее время кинетика электродных процессов представляет собой наиболее быстро развивающееся направление электрохимии. [12]
Ионика и электродика исследуют как равновесные, так и неравновесные явления и процессы. Изучение свойств ионных систем в равновесных условиях позволяет развить представления о строении растворов и расплавов электролитов и твердых электролитов, тогда как измерения в неравновесных условиях дают сведения об электропроводности ионных систем, а также о кинетике ионных реакций. В электро-дике исследованием равновесий на границе электрод - раствор ( расплав) занимается электрохимическая термодинамика. Измерения скоростей процессов на этой границе и выяснение закономерностей, которым они подчиняются, составляют объект кинетики электродных процессов или электрохимической кинетики. В настоящее время кинетика электродных процессов представляет собой одно из наиболее быстро развивающихся направлений теоретической электрохимии. [13]
У окиси железа, а также у некоторых других окислов кислород поверхности однороден, обменивается с постоянной скоростью. Интересно, что различие энергии связи кислорода на поверхности наблюдается у окислов, отличающихся сравнительно высокой каталитической активностью. Наиболее подвижный кислород может при этом занимать лишь небольшую долю поверхности. Это обстоятельство затрзтдняет изучение его свойств с помощью гетерообмена, так как требует измерения скорости процесса в области очень малых степеней обмена. [15]
Страницы: 1 2