Измерение - теплота - реакция
Cтраница 2
Теплота образования гипохлорита кальция в растворе, вычисленная на основании измерений теплоты реакции между Ca ( OH) 2aq и HClOaq, равна [5] 180 2 ккал / моль. [16]
Позже ( после 1850 г.), когда были разработаны методы измерения теплот реакций, было установлено, что реакции, при которых выделяется большое количество тепла, протекают самопроизвольно ( без воздействия извне) и часта даже бурно, в то время как реакции, при которых выделяется небольшое количество тепла, протекают спокойно, а иногда не до конца. [17]
Фирма Парр Инструменте ( США) предлагает сравнительно недорогой калориметр растворения с невысокой точностью измерения теплот реакций, растворения, смешения, разбавления и смачивания. [18]
В первом случае действие газоанализаторов основано на сравнении теплопроводности газовой смеси и воздуха, а во втором - на измерении теплоты реакции при дожигании горючих газов. В обоих случаях измерение производится электрическим методом. [19]
Очевидно, однако, что просто изменение общей энергии при переходе от исходных веществ к продуктам реакции, которое можно легко определить путем измерения теплоты реакции ДЯ, не может служить мерой различия их устойчивости, поскольку часто не наблюдается непосредственной корреляции между значениями АЯ и константой равновесия реакции К. Известны сильно экзотермические реакции с малыми константами равновесия ( небольшая степень превращения исходных веществ в продукты) и некоторые реакции с большими константами равновесия, являющиеся фактически эндотермическими ( энтальпия продуктов реакции выше, чем энтальпия исходных веществ); это ясно указывает на то, что при оценке относительной устойчивости химических соединений кроме энтальпии необходимо учитывать какой-то дополнительный фактор. [20]
Измерение ДЯ п At / для реакций основано на соотношениях H qp и MJqv. Измерение теплоты реакций при постоянном давлении или объеме равнозначно определению этих термодинамических функций. Внутри контейнера, имеющего постоянный объем, инициируют реакцию ( например, с помощью искры), а на-блюдаелтое изменение температуры можно перевести в qv, если знать общую теплоемкость калориметра. Существенно, чтобы вся теплота реакции затрачивалась на повышение температуры калориметра, а не просто выделялась в окружающую среду. [21]
Основным источником накопления термохимических данных служат прямые измерения теплот реакций и теплот растворения. Измерение теплот реакций возможно при соблюдении двух условий: 1) когда в калориметре протекает только одна реакция и 2) реакция протекает до конца достаточно быстро, так что теплота за время ее измерения не успевает рассеиваться в окружающую среду. Наиболее часто в таких расчетах используют теплоты образования веществ и ионов, теплоты сгорания и теплоты растворения. [22]
Число проделанных опытных измерений констант равновесия реакций углеводородов очень невелико. Измерение теплоты реакции обычно сводится к измерению теплоты сгорания, определяемой, как правило, при комнатной температуре. Тем не менее сочетание этих довольно ограниченных характеристик реакции с термодинамическими свойствами индивидуальных соединений, участвующих в реакции, позволяет расчитать AF и Л при определенных температурах. [23]
Основным источником накопления термохимических данных служат прямые измерения теплот реакций и теплот растворения. Измерение теплот реакций возможно при соблюдении двух условий: 1) когда в калориметре протекает только одна реакция и 2) реакция протекает до конца достаточно быстро, так что теплота за время ее измерения не успевает рассеиваться в окружающую среду. Наиболее часто в таких расчетах используют теплоты образования веществ и ионов, теплоты сгорания и теплоты растворения. [24]
Измерения теплот адсорбции дают представление о прочности связи кислорода с поверхностью и, как будет показано ниже, в сочетании с кинетическими измерениями позволяют получить дополнительные сведения о механизме взаимодействия кислорода с металлом. Измерения теплот реакции ( II) при различных значениях 6 в сочетании с измерениями скорости реакции ( II) позволяют сделать вывод о том, как связана теплота адсорбции кислорода с реакционной способностью адсорбированного кислорода. [25]
Таким образом, существует два различных метода определения энергии диссоциации связей. Первый, прямой метод требует измерения теплот реакций, в которых образуются радикалы, и это весьма существенно для измерения теплот образования радикалов. Второй, непрямой метод состоит в определении теплот образования соединений и в вычислении диссоциации связи по известным теплотам образования радикалов. [26]
Для анализа печных газов в настоящее время пользуются преимущественно электрическими газоанализаторами, получившими широкое распространение. В первом случае действие газоанализаторов основано на сравнении теплопроводностей газовой смеси и воздуха, а во втором-на измерении теплоты реакции при дожигании горючих газов. В обоих случаях измерения производятся электрическими методами. [27]
Методы термометрического титрования, применяемые для определения воды, по химизму делятся на две группы. В первом случае вода определяется по реакции с реагентом Карла Фишера, во втором, методы определения водосодержания материалов основаны на измерении теплоты реакции воды с уксусным ангидридом. [28]
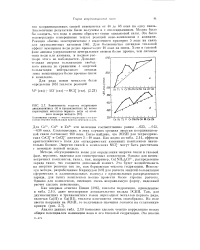 |
Зависимость теплоты гидратации двухвалентных ( б и трехвалентных ( а ионов переходных металлов первого ряда от атомного номера металла. [29] |
Аналогичные результаты были получены и с этнлендиамином. Можно было бы ожидать, что вода и амины образуют связи одинаковой силы. Это было подтверждено измерениями теплот реакций акво-комплексов с аминами. Для большинства лигандов тепловой эффект замещения воды редко превосходит 10 ккал на связь. Хотя в газовой фазе анионы удерживаются центральным атомом более прочно, чем лиганды типа воды или аммиака, в водном растворе итого не наблюдается. Дополнительная энергия сольватации свободного аниона по сравнению с энергией сольватации нейтрального лиганда лишь компенсирует более прочные связи в комплексе. [30]
Страницы: 1 2 3