Анион - тип
Cтраница 2
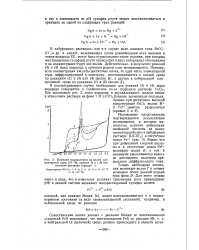 |
Влияние подкисления на волну элементарной серы ( 10 - 3М, кривая 2 в 1 М этаноловом растворе ( кривая. [16] |
В небуферных растворах, как ив случае волн анионов типа ВЮ3 IOIи др. и кислот, возникающих путем рекомбинации этих анионов и ионов водорода [3], могут быть осуществлены такие условия, при которых восстановление сульфида ртути происходит в двух интервалах потенциалов и на полярограмме будет две волны. Действительно, в результате реакций ( 3) и ( 4) ионы водорода в приэлектродном слое исчерпываются. [17]
Относительно молекулярного механизма действия третьего класса ингибиторов с общим анионом типа М02 - имеется несколько точек зрения. Эванс и Хор [1] предполагали одно время, что хромат-ионы отнимают, например, от двухвалентных ионов железа, перешедших в раствор, третий электрон, превращая их в трехвалентные ионы. [18]
По электростатическим причинам введение содержащих кислород двух - и трехзарядных анионов типа тартратов или цитратов благоприятствует образованию комплексов с трехзарядными катионами; комплексообразование с двухзарядными катионами гораздо слабее, но тем не менее оно часто имеет в анализе важное значение. Неизбирательность таких реагентов, как р-дике-тоны и купферрон, лишь слегка изменяется в случае лигандов типа 8-оксихинолина и антраниловой кислоты, где в образовании связи принимают участие кислород аниона и атом азота. Наоборот, существование сильного поля лигандов и образование в бис-комплексе с диметилглиоксимом ковалентных связей с четырьмя атомами азота приводят к повышению прочности комплекса Ni ( II) ( система d8), но не комплекса Fe ( III) ( d5) или ионов непереходных металлов. [19]
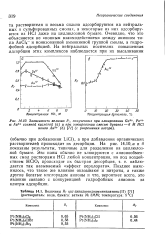 |
Зависимость величин R -, полученных при элюировании Ga3, Ро.| Величины Rf г с-дигалогендиамминплатины ( П ( растворитель. вода, бумага. ватман № ЗММ. температура. 5 С. [20] |
Очевидно, что это объясняется не ионным взаимодействием между анионом типа АиСЦ и ионизованной аммониевой группой смолы, а гидрофобной адсорбцией. [21]
Известно, что кислородные ионы и гидроксильные группы в анионах типа OgXOH - 1 - ( X - Si, P, S, Ge) обладают соответственно основными ( электрондонорными) и кислотными протондонорными) свойствами. В силу этого обстоятельства структурными единицами безводных кислых солей являются не отдельные анионы, а более или менее сложные анионные комплексы. [22]
Причина этого состоит в том, что протон может образовать водородную связь с комплексными цианидными анионами типа М - CN... [23]
 |
Сравнительные данные об изменении 6, / и i ингибиторами с общим анионом МО - при потенциале частичной пассивации. [24] |
Так же, как и ингибиторы, образующие труднорастворимые соединения, ингибиторы, содержащие общий анион типа МО. Вследствие этого плотность тока возрастает на той части поверхности, которая осталась в активном состоянии. Это также свидетельствует в пользу того, что они не восстанавливаются. [25]
Однако на практике это сделать довольно трудно, поскольку неметаллы имеют тенденцию к образованию многоатомных анионов типа SC42 -, NOs - и 52Оз2 -, которые в некоторых случаях конденсируются, образуя полиядерные формы, например полифосфаты. Кроме того, многие элементы, считающиеся металлами, могут образовывать анионы, не очень склонные к диссоциации на свободные ионы металла и анионные формы. К ним относятся, например, германаты, бериллаты, бораты и алюминаты. Здесь не будут рассматриваться анионные комплексы типа СиСЦ2 -, двухзарядного аниона Ca-EDTA и все другие соединения, существование которых определяется наличием подвижного равновесия. С другой стороны, целесообразно будет рассмотреть анионные комплексы, например Fe ( CN) e4 -, сохраняющиеся в термодинамически невыгодных условиях достаточно долгое время, чтобы их можно было аналитически идентифицировать. [26]
Это представление имеет общие черты с предложенным Гейровским [50] объяснением влияния зарядности катиона па восстановление анионов типа N03 - через образование ионных пар; однако одновременно оно во многом от него отличается. [27]
Большинство оксидов, галогени-дов и других соединений при нагревании в вакууме не изменяются, однако соли многоатомных анионов типа гидроксидов, карбонатов и нитратов разлагаются. Для сравнения термической стабильности удобно использовать величины теплот реакций разложения или стандартных теплот образования этих веществ. Например, при сравнении фторида MFn и оксида МОп / 2 данного катиона фторид оказывается стабильнее. [28]
Учитывая рассмотренные выше закономерности, можно полагать, что при внутренней анодной поляризации стали ингибиторами с общим анионом типа МО. Специфическое действие ингибиторов проявляется в том, что, адсорби-руясь на поверхности металла, они понижают общую свободную энергию системы и повышают стабильность пассивных пленок. В зависимости от природы адсорбированных частиц, их концентрации на поверхности и прочности связи меняется скорость растворения, поляризуемость и плотность тока, необходимая для пассивации, а также потенциал пассивации. В таких условиях пассивация может наступить и без большого внутреннего тока окислительно-восстановительной реакции ингибитора лишь за счет небольших плотностей тока реакции восстановления кислорода, растворенного з электролите. [29]
Поскольку в этом структурном типе атомы галогенов занимают два кристаллографически различных положения, множество солей со смешанными анионами типа ABC кристаллизуются именно в этой структуре-см. [30]
Страницы: 1 2 3 4