Любой анион
Cтраница 2
Химический анализ позволяет обнаружить различные анионы и катионы и не дает возможности выяснить характер и количество растворенных солей, поскольку каждый катион может соединиться с любым анионом, и наоборот. В большинстве случаев невозможно установить, какие соли образуются при соединении анионов с катионами, и можно только предполагать характер этих соединений. Получаемые результаты могут быть весьма далеки от реальных. [16]
 |
Взаимодействие анионов с AgNO3. [17] |
Некоторые анионы ( СОзЛ SiO -, РО -, BOJ, SO -), не проявляющие в водных растворах ни окислительных, ни восстановительных свойств, могут присутствовать совместно с любыми анионами. [18]
ОН) 2) л [ ( аиюи) /) / и-т Н2О ], где А х если z 2 и А 2х - если z 1, Mz - металл в степени окисления 2 или Li, M3 металлы в степени окисления 3, a onion - практически любой анион, который не образует устойчивых комплексов с этими катионами. Структура СДГ состоит из положительно заряженных гидроксидных слоев ( Mz i. [19]
Ион аммония должен считаться кислотой, так как он может отщепить ион водорода. Вообще любой анион проявляет в той или иной мере свойства основания. [20]
Пример, который дал повод для такого формального и столь далеко идущего вывода, основан на недоразумении. Хотя анионы могут быть потенциальными основаниями, нельзя утверждать, что любой анион при всех обстоятельствах является основанием. [21]
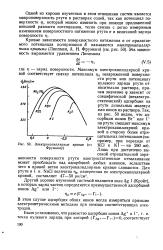 |
Электрокапиллярные кривые ( по Фрумкину. [22] |
Максимум электрокапиллярной кривой соответствует скачку потенциала ф незаряженной поверхности ртути или потенциалу нулевого заряда ртути относительно раствора, причем значение ф зависит от специфической ( неэлектростатической) адсорбции на ртути дипольных молекул или ионов из раствора. Лишь при достаточно высокой отрицательной заря-женности поверхности ртути электростатическое отталкивание может преобладать над адсорбцией любых анионов, вследствие чего в правой ветви электрокапиллярные кривые сливаются. [23]
Природа образующихся в растворе так называемых простых соединений обоих элементов вовсе не так уж проста. Имеется очень мало сведений о простых акво-ионах; практически в любых водных растворах с любыми анионами рутений и осмий образуют комплексные ионы. [24]
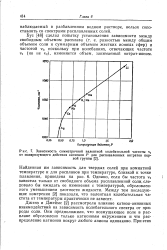 |
Зависимость симметричной валентной колебательной частоты vt от поляризующего действия катионов Р для расплавленных нитратов первой группы. [25] |
Они предположили, что возмущающее поле в расплаве обусловлено только катионным окружением и что распределение катионов вокруг любого аниона одинаково. [26]
Солюбилизация может происходить в результате сольватации не только анионов, но и катионов солей аминов. Сольватация катионов может иметь наибольшее значение для солюбилизации солей первичных аминов [123] и кислых солей двух - и многоосновных кислот с любыми анионами, так как она препятствует полимеризации этих солей, протекающей [98] вследствие образования водородных связей между катионами одних молекул соли и анионами других молекул соли. Кроме этих веществ с заметными электронодонорными свойствами способностью ( хотя и меньшей) солюбилизировать соли первичных аминов обладают и некоторые вещества, например бензол, имеющие очень слабые основные свойства. [27]
Еще более общий характер, чем теория Льюиса, имеет теория Усановича. Кислотами он предложил называть вещества, способные отдавать любые катионы, в том числе протоны и другие электроположительные частицы, и присоединять любые анионы, а основаниями - вещества, способные отдавать анионы или другие электроотрицательные частицы, включая электроны, и присоединять протоны. [28]
Основное преимущество процесса Глууда, по сравнению с вышеописанным циклическим процессом получения соды и хлористого аммония, заключается в том, что можно провести кристаллизацию NH4C1, не прибегая к холодильным установкам. Для того чтобы NH4C1 лучше кристаллизовался, в маточный раствор вводят известное количество так называемой промежуточной соли NH4A, где А - любой анион, кроме хлора. Присутствие в растворе такой соли [ например, NH4N03, ( NH4) 2S04) смещает ионное равновесие реакции, и растворимость NH4C1 снижается, в результате чего происходит его выделение из раствора при обычной температуре. [29]
Основное преимущество процесса Глууда, по сравнению с вышеописанным циклическим процессом получения соды и хлористого аммония, заключается в том, что можно провести кристаллизацию NH4C1, не прибегая к холодильным установкам. Для того чтобы NH4C1 лучше кристаллизовался, в маточный раствор вводят известное количество так называемой промежуточной соли NH4A, где А - любой анион, кроме хлора. Присутствие в растворе такой соли [ например, NH4NOS, ( NH4) 2SO4) смещает ионное равновесие реакции, и растворимость NH4C1 снижается, в результате чего происходит его выделение из раствора при обычной температуре. [30]
Страницы: 1 2 3