Изобара - равновесие
Cтраница 1
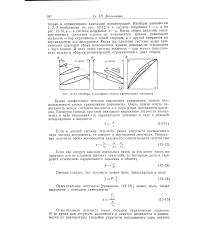 |
Изобары и изотермы вблизи критического состояния. [1] |
Изобары равновесия 1, 2, 3 изображены на рис. 12 - 12 6 в системе координат t - х, а на рис. 12 - 12, в - в системе координат х - у. Когда общее давление выше критического давления одного из компонентов, кривая равновесия жидкость - пар ограничена с одной стороны, а с другой опирается на вертикальную ось диаграммы. Когда же давление системы выше критических давлений обоих компонентов, кривая равновесия ограничена с двух сторон. В силу этого система жидкость - пар может существовать только в области концентраций, ограниченной с двух сторон. [2]
Расчет изобары равновесия дистилляции реального раствора проводится в такой последовательности. [3]
Изотермы и изобары равновесия раствор - пар представляют собой частный случай диаграммы состав - свойство. Получая эти диаграммы, мы применяем к исследованию равновесия раствор - пар метод физико-химического анализа. [4]
Изотермы и изобары равновесия раствор - пар представляют собой частный случай диаграммы состав - свойство. Получая эти диаграммы, мы применяем к исследованию равновесия раствор - пар метод физико-химического анализа. [5]
Как видно из изобары равновесия (5.32), константа равновесия экзотермической реакции уменьшается, а эндотермической реакции возрастает с повышением температуры. С увеличением абсолютного значения энтальпии реакции и уменьшением температуры чувствительность константы равновесия реакции к изменению температуры повышается. [6]
На изотермах и изобарах равновесия привлекают внимание точки максимума и минимума. Уравнение (7.89) показывает, что экстремальныеточки имеют место в случае, когда состав равновесных фаз одинаков. Равновесные фазы одинакового состава называют азеотропными, или не-раздельнокипящими. Анализ уравнения (7.89) дан редактором русского перевода трудов Гиббса В. К. Семенченко в его примечаниях [ А - 4, стр. [7]
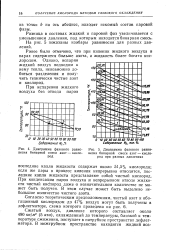 |
Диаграмма фазового равновесия бинарной смеси азот - кислород.| Диаграмма фазового равновесия бинарной смеси азот - кислород при разных давлениях. [8] |
На рис. 5 показаны изобары равновесия для разных давлений. [9]
При более высокой температуре изобары равновесия как и изотермы, естественно, отрываются от оси этого компонента и на них появляется критическая точка смеси. Она лежит при экстремальном значении температуры. При фазовом равновесии по обе стороны от критической точки на пограничной кривой всегда должны быть точки с одинаковой температурой. [10]
Ветви жидкости и пара изобары равновесия Т - N2 при критическом давлении азеотропа подойдут к критической точке с общей горизонтальной касательной ( как и изотерма Р - jV2; см. разд. [11]
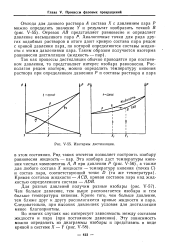 |
Изотермы дистилляции. [12] |
Ряд таких отсчетов позволяет построить изобару равновесия жидкость - пар. [13]
 |
Схема разбавления. [14] |
Система линий АВ и АЕ определяет изобару равновесия pi, причем кривая АВ относится к жидкости ( концентрация жидкости в зависимости от температуры кипения), а прямая АЕ - к пару, находящемуся в равновесии с жидкостью. Для других давлений получим аналогичные кривые для жидкости, представляющие температуры кипения растворов в зависимости от концентрации при этих давлениях. [15]
Страницы: 1 2 3 4