Изобара - равновесие
Cтраница 3
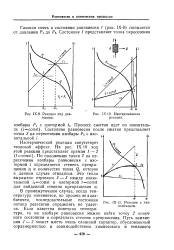 |
Реакция под давлением.| Изотермическая реакция.| Реакция с теплообменом. [31] |
Изотермической реакции сопутствует тепловой эффект, На рис. IX-10 ход этой реакции представляет прямая / - 2 ( / const), По положению точки 2 на пересечении изобары равновесия с изотермой / определяется степень превращения х и количество тепла Q, которое в данном случае отводится. [32]
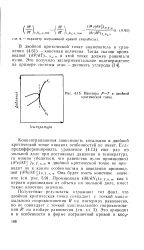 |
Изостера Р - Т в двойной критической точке. [33] |
Полученные результаты отражают тот факт, что двойная критическая точка совпадает с точкой максимального соприкосновения R на изотермах равновесия, но не совпадает с точкой максимального соприкосновения R на изобаре равновесия ( см. гл. [34]
Точка перегиба на изобарах - изотермах v - Ni связана с расположением точки максимального соприкосновения R на изотермах равновесия v - Nt ( см. рис. 3.3), а точка перегиба на изобарах - изотермах h - Ni - с расположением точки К на изобарах равновесия Т - Ni. В системах, в которых критические давление и температура одного компонента меньше, чем у другого, концентрационная зависимость энтальпии имеет тот же характер, что и концентрационная зависимость объема. [35]
При дальнейшем повышении давления в двухфазной области равновесия жидкость - газ появятся вторая критическая точка ( лежащая также при минимальной температуре) и вторая точка максимального соприкосновения. Какая-то из последующих изобар равновесия Т - ЛГ2 будет иметь максимальное давление, что видно из схемы на рис. 3.16. При дальнейшем повышении температуры давление будет падать. [36]
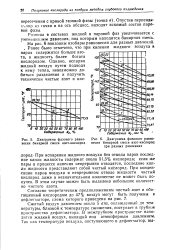 |
Диаграмма фазового равновесия бинарной смеси азот-кислород.| Диаграмма фазового равновесия бинарной смеси азот-кислород при разных давлениях. [37] |
Разница в составах жидкой и паровой фаз увеличивается с уменьшением давления, под которым находится бинарная смесь. На рис. 6 показаны изобары равновесия для разных давлений. Ранее было отмечено, что при кипении жидкого воздуха в парах содержится больше азота, а жидкость более богата кислородом. [38]
Но этот знак противоположен знаку производных от давления по мольной доле при изотермических условиях. Кривая жидкой фазы на изобаре равновесия лежит ниже ( при более низких температурах), чем кривая газовой фазы. [39]
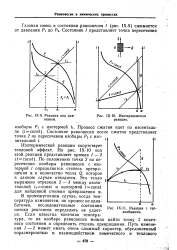 |
Реакция под давлением.| Изотермическая реакция.| Реакция с теплообменом. [40] |
Изотермической реакции сопутствует тепловой эффект. По положению точки 2 на пересечения изобары равновесия с изотермой t определяется степень превращения а и количество тепла Q, которое в данном случае отводится. [41]
В промежуточном случае, когда температура изменяется, но процесс не адиа-батичен, последовательные состояния потока реагентов определить не удается. Если известна конечная температура, то на изобаре равновесия можно найти точку 2 конечного состояния и определить степень превращения. [42]
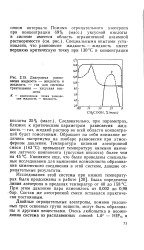 |
Диаграмма равновесия жидкость - жидкость и жидкость - газ для системы тризтиламин - уксусная кислота. [43] |
Обращает на себя внимание величина экстремума на изобаре равновесия при атмосферном давлении. Температура кипения азеотропной смеси ( 163 С) превышает температуру кипения наименее летучего компонента ( уксусная кислота) более чем на 45 С. Упомянем еще, что были проведены специальные исследования для выяснения возможности образования химического соединения в этой системе, давшие отрицательные результаты. [44]
В промежуточном случае, когда температура изменяется, но процесс не адиа-батичен, последовательные состояния потока реагентов определить не удается. Если известна конечная температура, то на изобаре равновесия можно найти точку 2 конечного состояния и определить степень превращения. [45]
Страницы: 1 2 3 4