Изобара - растворимость
Cтраница 3
В гид ридооб разу ющих металлах процесс сорбции водорода включает в себя все три стадии; при образовании гидридов ДЯраств становится меньше нуля и растворимость водорода понижается с повышением температуры, но это будет проявляться тогда, когда температура будет выше температуры термодинамической устойчивости гидридов. На рис. 9.31 приведена изобара растворимости водорода в титане в зависимости от температуры, причем снижение растворимости начинается при температурах выше 600 К. [31]
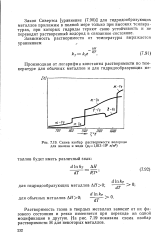 |
Схема изобар растворимости водорода для железа и меди ( р0 1 013 - 105 к / ж2. [32] |
Растворимость газов в твердых металлах зависит от их фазового состояния и резко изменяется при переходе из одной модификации в другую. На рис. 7.19 показана схема изобар растворимости Н для некоторых металлов. [33]
В связи с отрицательным температурным коэффициентом растворимости и весьма малой зависимостью от плотности ( координационное число равно 0 6) растворимость магнетита при повышении температуры уменьшается. Это и наблюдается, как видно из расчетной изобары растворимости магнетита для давления 300 кгс / см2 ( см. рис. 1 - 13) - последняя не имеет минимума, чем отличается от изобар растворимости окиси меди, кремне-кислоты, хлористого кальция и многих других соединений. [34]
Левая часть ее характеризует область паровых растворов, находящихся в равновесии с водными растворами, правая - область равновесия перегретого водяного пара с твердой солью. Геометрическое место точек, соответствующих температурам кипения насыщенных растворов на изобарах растворимости хлористого натрия в паре, образует линию насыщенных паровых растворов данной соли. [35]
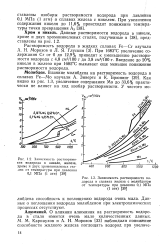 |
Зависимость растворимости водорода в сплавах железа с молибденом от температуры при давлении 0 1 МПа ( 1 ати. [36] |
Как видно из рис. 1.3, увеличение содержания Мо до 33 6 % практически не влияет на ход изобар растворимости. [37]
Изложенный в настоящей главе материал выявил ряд существенных положений, характерных для фазовых равновесий в водно-солевых системах при повышенных температурах и давлениях. Особенности растворимости солей во флюидной фазе, такие, как значительное повышение растворимости при увеличении давления, закономерное изменение хода изотерм и изобар растворимости, изменение знака температурного коэффициента растворимости с повышением давления, обусловлены близостью второй критической точки Q, и это показывает, какое большое значение имеет определение параметров, соответствующих точке Q для выяснения вопроса о поведении солей в надкритических областях. [38]
В связи с отрицательным температурным коэффициентом растворимости и весьма малой зависимостью от плотности ( координационное число равно 0 6) растворимость магнетита при повышении температуры уменьшается. Это и наблюдается, как видно из расчетной изобары растворимости магнетита для давления 300 кгс / см2 ( см. рис. 1 - 13) - последняя не имеет минимума, чем отличается от изобар растворимости окиси меди, кремне-кислоты, хлористого кальция и многих других соединений. [39]
Под влиянием изменения плотности Н2О с температурой растворимость полярных веществ в перегретом паре, в частности солей, с ростом температуры должна была бы только уменьшаться. Под влиянием ослабления прочности связей в кристаллической решетке при увеличении температуры растворимость солей в перегретом паре с ростом температуры должна была бы только увеличиваться. Реальные изобары растворимости солей являются результатом действия обоих факторов. При температурах, отвечающих минимуму на изобарах растворимости, влияние этих факторов уравновешивается. При меньших температурах ( левая ветвь кривой) преобладает влияние изменения плотности Н2О, при больших температурах ( правая ветвь кривой) - фактор ослабления связей в кристаллической решетке. [40]
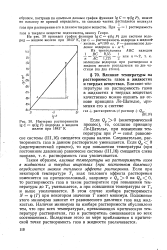 |
Изотерма растворимости. [41] |
Таким образом, влияние температуры на растворимость газов в жидкостях и твердых веществах ( при постоянном давлении) определяется знаком теплового эффекта растворения. Если при некоторой температуре 7 знак теплового эффекта растворения изменяется на противоположный, например с Qp 0 на Qp О, то растворимость газа в таком растворителе при повышении температуры до 7 уменьшается, а при повышении температуры от 7 и выше увеличивается. В этом случае изобара растворимости JV ф ( Т) при некотором значении Т имеет минимум. Положение этого минимума зависит от равновесного давления газа над жидкостью. Наличие минимума на изобаре растворимости обусловлено тем, что при всех температурах, превышающих критическую температуру растворителя, газ и растворитель смешиваются во всех соотношениях. Вследствие этого по мере приближения к критической точке растворимость газа в жидкости увеличивается. [42]
 |
Растворимость водорода в железе и никеле в зависимости от температуры ( рн 1 013 105 Ли2. [43] |
Отношение к элементарным окислителям - Гидриды для металлов семейства железа не получены, - так как их химическая активность слишком мала. Только для железа известен крайне неустойчивый гидрид FeH, образующийся в условиях сильной радиации. Тем не менее с водородом эти металлы образуют твердые растворы внедрения, концентрация водорода в которых зависит от фазовых превращений: водород растворяется значительно в жидких - металлах ( №), причем с повышением температуры его растворимость сначала растет, а затем падает, приближаясь к нулю при температуре кипения. На рис. 168 приведены изобары растворимости для железа и никеля. [44]
При сверхкритических давлениях снижение плотности Н2О с ростом температуры происходит непрерывно во всем диапазоне температур. Резким падением плотности выделяется зона максимальной теплоемкости ( см. рис. В. При давлениях 24 - 30 МПа она отвечает интервалу температур 350 - 400 С. Из рис. 5.8, где показаны изобары растворимости ряда соединений для давления 25 МПа, можно видеть, что эта область температур характеризуется уменьшением растворимости всех соединений. Абсолютные снижения растворимости для разных веществ в этой области температур различны; так, у NaCl и СаСЬ растворимость снижается примерно в 60 - 100 раз, у Mg ( OH) 2 - примерно в 10 раз, у Fe3O4 - примерно в 5 раз. [45]
Страницы: 1 2 3 4