Аномалия - теплоемкость
Cтраница 1
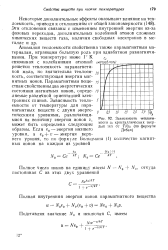 |
Зависимость теплоем. [1] |
Аномалия теплоемкости свойственна также парамагнитным материалам, играющим большую роль при адиабатном размагничивании. При температуре ниже 1 К с связанная с колебаниями атомной решетки теплоемкость парамагнетиков мала, но значительна теплоем - кость, соответствующая энергии магнитных ионов. Парамагнитным веще - / ствам свойственны два энергетических состояния магнитных ионов, опреде - / 0 ляемые различной ориентацией электронных спинов. [2]
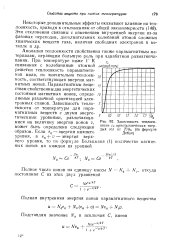 |
Зависимость теплоемкости cv кристаллических твердых тел от Т / Вц ( по формуле Дебая. [3] |
Аномалия теплоемкости свойственна также парамагнитным материалам, играющим большую роль при адиабатном размагничивании. При температуре ниже 1 К связанная с колебаниями атомной решетки теплоемкость парамагнетиков мала, но значительна теплоемкость, соответствующая энергии магнитных ионов. Парамагнитным веще-ствам свойственны два энергетических состояния магнитных ионов, опреде - to ляемые различной ориентацией электронных спинов. Зависимость теплоемкости от температуры для парамагнитных веществ с двумя энергетическими уровнями, различающимися на величину энергии ионов v, может быть определена следующим образом. [4]
Аномалии теплоемкости при фазовых превращениях твердых тел наблюдаются при переходе а-железа в у-железо [135] или а-кварца в р-кварц. [5]
Флуктуационную аномалию теплоемкости в параэлектрической фазе в одноосных сегнетоэлектриках можно, видимо, обнаружить лишь с помощью прецизионных экспериментов. Последние данные как будто бы подтверждают выводы теории. На рис. 6.4 представлена температурная зависимость теплоемкости триглицинсульфа-та в параэлектрической фазе в логарифмическом масштабе. Видна весьма малая аномалия теплоемкости, которая, как видно, хорошо описывается логарифмической функцией. [6]
Этот переход заметен по аномалии теплоемкости. Температуру 7, при которой возникает аномалия, благодаря характерной форме последней ( фиг. Кроме того, наблюдая жидкость в тот момент, когда ее температура становится ниже 7, можно увидеть удивительное изменение. Чтобы поддерживать температуру жидкого гелия ниже 4 2 К, уменьшают давление пара над гелиевой ванной, так что кипение происходит при пониженном давлении. Выше 7 внутри гелия, как и в обычной жидкости, образуются пузырьки пара и весь он кипит: пузырьки поднимаются на поверхность и испаряются. Но, как только температура достигает точки Я-перехода, гелий становится абсолютно неподвижным, а пузырьки исчезают. Таким образом, Гя представляет собой температуру перехода между двумя различными формами жидкого Не4, называемыми гелием I выше Я-точки и гелием II ниже ее. [7]
В настоящей заметке предлагается возможное объяснение аномалии теплоемкости Не, основанное на том, что дальнодействующие силы притяжения способны привести и к фазовому переходу существенно иной природы с заведомо большим значением AT / TO Речь идет о перестройке системы не в канале частица-частица, как в случае сверхтекучести, а в канале частица-дырка; при этом система переходит в особое пространственно неоднородное состояние. Обсуждаемая аномалия является, таким образом, своего рода предвестником такого перехода. [8]
До настоящего времени нет никаких доказательств существования аномалии теплоемкости, связанной с этим превращением, и установлено лишь его влияние на температурный ход сопротивления, который в первом приближении кажется совершенно плавным. Характерным свойством таких мартенситовых превращений, по-видимому, является то, что температура, при которой они наступают, и полнота их развития могут в сильной степени изменяться в зависимости от холодной обработки материала, а также от наличия в нем локальных напряжений. В связи с этим полное превращение в данном образце может оказаться размазанным в значительном интервале температур, что делает его обнаружение термическими методами затруднительным. [9]
До настоящего времени нет никаких доказательств существования аномалии теплоемкости, связанной с этим превращением, и установлено лишь его влияние па температурный ход сопротивления, который и нервом приближении кажется совершенно плавным. Характерным свойством таких ыартепсптовых превращений, по-видимому, является то, что температура, при которой они наступают, и полнота их развития могут в сильной степени изменяться в зависимости от холодной обработки материала, а также от наличия в нем локальных напряжений. В связи с этим полное превращение г, данном образце может оказаться размазанным в значительном интервале температур, что делает его обнаружение термическими методами затруднительным. [10]
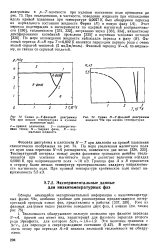 |
Схема Я - Г - фазовой диаграммы. [11] |
В противоположность этому при переходе Л - - 5 никаких аномалий теплоемкости не обнаружено. [12]
Более ранняя работа Симона и Пиккарда характеризуется систематической погрешностью из-за большой аномалии теплоемкости в области 7 К, не подтвержденной другими работами. Работа [33] дает несколько заниженные значения теплоемкости при низких температурах. Исследование Симона и Цайдлера ( 1926 г.) [37] долгое время использовалось как основное в интервале 20 - 100 К. Однако данные этой работы существенно расходятся с позднейшими исследованиями [9, 40] и не обнаруживают аномалии теплоемкости в зоне мартенситного превращения натрия. Работы [20, 39] могут служить только для оценок. Эти работы, выполненные на калориметрах непосредственного нагрева с адиабатической оболочкой, хорошо согласуются между собой. Тем не менее при Т 100 К данные работы 1954 г. оказываются на 0 5 - 1 % ниже данных работы 1960 г. и, кроме того, обнаруживают аномалию при Г 200 К. [13]
Точка К максимума кривой - критическая: в окрестности этой точки наблюдаются аномалия теплоемкости, критич. Существуют жидкие системы ( напр. [15]
Страницы: 1 2 3 4 5