Электрохимическое восстановление - органическое соединение
Cтраница 2
Поэтому в химии протона рассматриваются в основном следующие вопросы: а) существование протона в сольватированной форме; б) перенос протона от одного типа ионов или молекул к другому в кислотно-основных реакциях; в) перенос протона при электропроводности в слабом поле и г) гетерогенный перенос в электродных процессах, включающих выделение молекул, образование Н - спла-вов ( например, систем а - и fi - PdH), и в других гетерогенных электрохимических реакциях с присоединением или отрывом протона, например в стадиях выделения кислорода на электродах и при электрохимическом восстановлении органических соединений. Очевидно, что кинетика указанных процессов, в которых возможен туннельный переход протонов, будет в значительной степени определяться термодинамикой и молекулярным механизмом сольватации. Характерной особенностью процессов переноса протона является также и то, что в них формально участвует только протон ядра, в то время как почти во всех химических реакциях с участием других атомов в образовании переходного комплекса принимает участие ядро вместе с окружающими его электронами. [16]
Электрохимическое восстановление органических соединений, несмотря па очевидные преимущества по сравнению с химическим, все еще слабо внедряется в производство. Это объясняется многими причинами, главная из которых - недостаток теоретических знаний механизма электрохимического восстановления, особенно в приложении к органическим соединениям. [17]
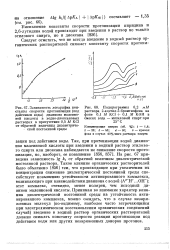
Эта стадия в случае многих органических соединений ( в частности таких, молекулы которых содержат систему сопряженных связей) протекает обратимо и достаточно быстро. Как показывают исследования последних лет с применением различных экспериментальных приемов комплексное использование методов полярографии и фараде-евского импеданса с различными частотами, переменнотоковой полярографии и др.) значения стандартных констант скорости электродных процессов ks при электрохимическом восстановлении органических соединений в диметилформамиде и других апротонных растворителях составляют единицы и десятки сантиметров в секунду. Эти значения действительно малы - порядка ( 0 04 0 02) - г - ( 0 07 0 04) см / с, даже если процесс переноса осложнен химической стадией с участием образующихся анион-радикалов, как, например, в случае катодного восстановления толилэлементофенилацетиленов ( Э 5, Se, Те) в диметилформамиде. Это подтверждает обратимость процесса переноса первого электрона в условиях полярографического исследования. Необходимо отметить, что в последнем примере представляют интерес не только сами значения констант скорости переноса электрона, но и методическая сторона - приведенные значения ks получены для электродных процессов, которые сопровождаются и химической реакцией, и адсорбцией компонентов окислительно-восстановительной системы. Значение ks может служить критерием для оценки механизма электровосстановления веществ, как это показано, например, Глезером и Поспишилом [ 19, с. Важным в выявлении механизма электровосстановления является также вопрос об энергии и энтропии активации реакции переноса заряда, который связан со строением молекул и состоянием их в приэлектродном слое или на поверхности электрода. Речь идет, в первую очередь, о наличии в молекулах восстанавливающихся веществ функциональных групп с элект-ронофильными свойствами либо системы сопряженных связей, благодаря чему облегчается процесс динамической поляризации молекул и, следовательно, появляется возможность передачи электрона от электрода на такие молекулы. [18]
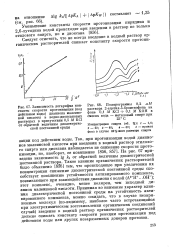
На рис. 67 приведена зависимость lg от обратной величины диэлектрической постоянной раствора. ОН -); этот комплекс, очевидно, менее полярен, чем исходный ди-анион малеиновой кислоты. Принимая во внимание характер влияния диэлектрической постоянной среды на устойчивость активированного комплекса, можно ожидать, что в случае незаряженных молекул ( по-видимому, наиболее часто встречающийся при электрохимическом восстановлении органических соединений случай) введение в водный раствор органических растворителей должно снижать константу скорости реакции протонизации под действием воды или других незаряженных доноров протонов. [20]
На рис. 67 приведена зависимость lg k от обратной величины диэлектрической постоянной раствора. ОН -); этот комплекс, очевидно, менее полярен, чем исходный ди-анион малеиновой кислоты. Принимая во внимание характер влияния диэлектрической постоянной среды на устойчивость активированного комплекса, можно ожидать, что в случае незаряженных молекул ( по-видимому, наиболее часто встречающийся при электрохимическом восстановлении органических соединений случай) введение в водный раствор органических растворителей должно снижать константу скорости реакции протонизации под действием воды или других незаряженных доноров протонов. [22]
Страницы: 1 2