Аквакатион
Cтраница 4
Для подавления гидролиза солей, при растворении которых образуются аквакатионы, в раствор вводят избыточное количество соответствующей сильной кислоты. [46]
Соли ванадия ( II) VCb, VSO4 образуют аквакатионы [ У ( Н2О) б) 1, придающие раствору фиолетовую окраску. [47]
Состоянию ионов с координационным числом 6 в крайних случаях соответствуют аквакатион [ М ( Н20) 6 ] 1г в сильно кислом или гидроксоанион [ М ( ОН6) ] 1Г6 в сильно щелочном растворе. [48]
В водном растворе Cu ( II) находится в виде аквакатиона с коор динационным числом меди, равным 4 ( может быть также 5 и 6); при этом [ Си ( Н2О) 4 ] 2 проявляет свойства слабой кислоты. Гидроксид меди ( П) Си ( ОН) 2 - амфотерный с преобладанием основных свойств. [49]
Катионы s - элементов в водных растворах присутствуют в виде неустойчивых аквакатионов, содержащих чаще всего четыре или шесть молисул воды: [ LHHiOuf, [ Be ( H2O) 4 ], [ К ( Н2О) б ], [ Mg ( H2O6 ] и др. По мере увеличения радиуса катиона и уменьшения его заряда устойчивость аквакатионов падает. Она уменьшается в каждой группе сверху вниз и при переходе от ПА - к IA-группе. У остальных элементов аквакатионы входят в состав кристаллов: [ Mg ( H2O) 6 ] Cl2, [ Ве ( Н2О) 4 ] ( МОз2 и др. Гидролизу ( см. раздел 10.3) соли s - элементов ( кроме беоиллия) не подвергаются. [50]
Что же касается структурирующего взаимодействия, то это может быть взаимодействие аквакатионов с внешнесфер-ной водой посредством образования водородных связей. В соответствии с концепцией Фрэнка ( 36 ] подобное взаимодействие должно стимулироваться значительной поляризацией молекул воды-в рассматриваемых аквакатионах. Другая причина этого роста, как уже говорилось, может быть связана с усилением отталкивания между ионами. [51]
В частности, в работе [28] было показано, что понижение симметрии аквакатионов, при прочих равных условиях, способствует усилению их гидролиза. [52]
Однозарядные крупные катионы металлов образуют слабые ион-дипольные связи с молекулами воды, их аквакатионы [ Ag ( H2O2) ], [ K ( H20) g ], [ Na ( H2O) 6 ] и др.) очень неустойчивы. Число связанных молекул воды в подобных аквакатионах зависит от многих факторов и заметных кислотных свойств лабильные аквакатионы не проявляют. [53]
При кристаллизации или осаждении из водных растворов солей Fe, Co и Ni аквакатионы, как правило, состава [ М ( Н2О) б ] входят в образующуюся кристаллическую решетку соли. [54]
Изменение цвета хлорида кобальта связано с потерей части воды, входящей в состав аквакатиона кобальта. [55]
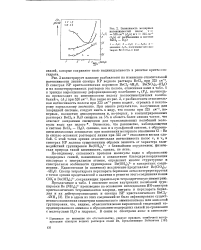 |
Зависимость молярных интенсивностей полос v 526 см 1 ( 1 1с и v 325 ыГ1 ( / 4 / с от разбавления в системе ВеС12 - Н20. [56] |
По-видимому, склонность протонов молекулы воды к образованию водородных связей, повышенная в аквакатионе благодаря координации кислорода с центральным атомом, определяет многие структурные и спектральные особенности группировок Ве ( ОН2) 42 в конкретных соединениях. [57]
Страницы: 1 2 3 4