Активность - платина
Cтраница 3
Хлор вызывает более резкое отравление катализатора. При содержании в газе 0 02 % хлора активность платины снижается в 3 6 раза. После прекращения подачи хлора активность восстанавливается, но не полностью. [31]
Хлор вызывает более резкое отравление катализатора. При содержании в газе 0 02 % хлора активность платины снижается в 3 6 раза. После прекращения, подачи хлора активность восстанавливается, но не полностью. [32]
В однофазной области, примыкающей к чистой платине, увеличение содержания золота приводит к снижению активности; при дальнейшем увеличении содержания золота и переходе в двухфазную область удельная каталитическая активность резко возрастает и становится значительно выше, чем для чистой платины. В пределах двухфазной области активность снижается незначительно и остается выше активности платины, но при переходе во вторую однофазную область, примыкающую к золоту, падает очень резко и становится ниже активности чистого золота. [33]
Оказалось, что при варьировании количеств формальдегида или щелочи, применяемых для восстановления платинохлористо-водородной кислоты, активность катализатора по отношению к реакции С5 - дегидроциклизации в обоих случаях проходит через острый максимум. В то же время температура восстановления формальдегидом не оказывает на активность платины в реакции С6 - дегидроциклизации никакого влияния. Эти и некоторые другие обсужденные в цитированной работе факты заставляют думать, что названные две реакции протекают на разных активных центрах. [34]
Нами было изучено также влияние меди и серебра на каталитическую активность платины. Было установлено, что первые порции серебра и меди более резко подавляют активность платины, чем палладия. [35]
В работе [20] сопоставлена электрокаталитическая активность микрокристаллов платины с размером - 50 и ниже 15 А. Авторы приходят к выводу, что удельная ( в расчете на истинную поверхность) активность высокодисперсной платины существенно выше. Однако способы изготовления обоих типов катализаторов сильно различаются, что не позволяет распространить этот вывод на другие системы. [36]
Наиболее сильным ядом для платинового катализатора является фосфористый водород. Ядом для катализатора является также сероводород, присутствие которого в газе в количестве 1 % снижает активность платины на несколько процентов. При меньшей концентрации сероводорода в газе активность катализатора может быть восстановлена в случае последующей работы на чистом газе. [37]
Самый активный из этих катализаторов - платина; с ее помощью можно гидрировать даже устойчивые ароматические связи при комнатной температуре без давления. Никель Ренея и палладий ( в виде окиси палладия или осажденный на активированном угле, сульфате бария, сульфате стронция или карбонате кальция) не достигают активности платины, однако дают возможность гидрировать неароматические кратные связи при комнатной температуре. Благодаря этому становится возможным селективное гидрирование, например стирола до этилбензола. [38]
Опыты Акирече [22], применявшего скись платины как катализатор, показывают, что на скорость реакции гидрогенизации салициловой кислоты влияет не только растворитель ( а, следовательно, и раствсримссть гидрируемого вещества), но и активность катализатора. Он нашел, что при растворении салициловой кислоты в уксусной кислоте уа каталитическую реакцию затрачивается всего несколько секунд и платина скоро стансвится не активной; если же она растворена в спирте, катализ требует несколько минут и активность платины снижается медленнее. При гидрогенизации салициловой кислоты в декалине каталитическая реакция требовала еще - больше времени и было достаточно отмыть смесь спиртом для удаления избытка салициловой кислоты, как наступала реактивация платинового катализатора. [39]
Отравление может быть обратимым и необратимым. Примером обратимого отравления может служить дезактивация платины, происходящая в присутствии СО, CS2, С2Н4 и пр. Активность платины восстанавливается при устранении загрязняющих примесей. Примером необратимого отравления является действие сернистых соединений при гидрировании в присутствии никеля и ряда других металлов. Более развитая поверхность катализатора делает его менее чувствительным к ядам, так как отравление пропорционально количеству яда. [40]
По-видимому, металл, насыщенный водородом, не содержит ни растворенных окислов, ни окислов на поверхности в контакте с металлом. К этим данным также можно отнести и сообщения [14] о том, что активность палладия, предварительно обработанного кислородом, увеличивается в реакции На Qz - ШО в 30 - 50 раз по сравнению с тем, что наблюдается при предварительной обработке его водородом. Для той же реакции активность платины после анодной поляризации увеличивается за счет окисления так же, как и при соответствующей химической обработке. При катодной поляризации такой активации Pt не наблюдается. [41]
Пааль с сотрудниками [23] наноси. В отдельных случаях в качестве носителя применялись окислы или карбонаты металлов. Было обнаружено, что активность платины или палладия уменьшается в присутствии многих тяжелых металлов - ртути, свинца, висмута, олова, а также цинка, кадмия, меди и железа. С другой стороны, платина, нанесенная на металлический магний, оказалась активной. Список токсичных и нетоксичных металлов, составленный Паалем, впоследствии был подтвержден другими исследователями и дополнен на основе более поздних работ. [42]
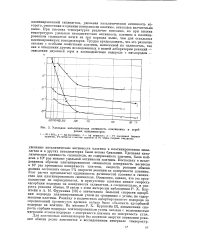 |
Удельная каталитическая активность платиновых и серебряных катализаторов. [43] |
Удельная каталитическая активность силикагеля, не содержавшего платины, была найдена в 106 раз меньше удельной активности платины. Поскольку в исследованном образце платинированного силикагеля поверхность носителя в 10 раз превышала поверхность платины, скорость реакции обмена должна составлять около 1 % скорости реакции на поверхности платины. Этот расчет предполагает аддитивность активностей платины и силикагеля для платинированного силикагеля. Возможно, однако, что это предположение не оправдывается, и присутствие платины меняет скорость адсорбции водорода на поверхности силикагеля, а следовательно, и скорость реакции обмена. Бур-штейн и А. Н. Фрумкина [10] о значительно большей скорости адсорбции водорода платинированным углем по сравнению с углем, не содержавшим платины. [44]
Мышьяковистый ангидрид, вследствие способности восстанавливаться в арсин, оказывается сильным ядом при гидрогенизации с платиной, применяемой в качестве катализатора. Тот же самый яд относительно слабо действует на изменение активности платины при применении ее для разложения перекиси водорода. [45]
Страницы: 1 2 3 4