Ионная активность
Cтраница 2
Но в первом члене правой части уравнения остается отношение ионных активностей, которые неопределимы. [16]
ЭДС простой химической цепи зависит от природы электродов и от средней ионной активности электролита. [17]
Таким образом, мембранный потенциал выражается через числа переноса и среднюю ионную активность, обе эти величины могут быть определены экспериментально. [18]
Значение В, приведенное для системы формамида, основано на использовании средней ионной активности в изотерме, в то время как обычно применяли активность соли. [19]
Таким образом, если мы можем признать идентичность ( Н) со средней ионной активностью НС1, отнесенной к идеальному разбавленному водному раствору, то активности НС1 в различных растворителях будут, очевидно, представлять при тех же концентрациях относительную ( но обратную) меру основности этих растворителей. [20]
Уравнение Нернста выражает мембранный концентрационный потенциал через средние числа переноса в мембране и средние ионные активности во внешних растворах. Применяя положения теории фиксированного заряда и внося определенные упрощающие ограничения, Теорелл [ Т12 ] и независимо от него Мейер и Сивере [ М57, 58 ] вывели уравнение для мембранного потенциала, включающее значения внешних концентраций, ионных подвижностей в мембране и концентрацию фиксированного иона. [21]
Изготовлены миниатюрные электроды [21] с жидким ионооб-менником такого размера, что ими можно измерять ионную активность во внутриклеточной жидкости. [22]
 |
Зависимость - lg 4 2 OI логарифма ионной силы в водных растворах СаСЬ. [23] |
Таким образом, и после цитированной работы Бейтса и Алфенаара [82] проблема построения таких шкал ионной активности, которые позволяли бы приписывать получаемым на их основе величинам достаточно ясный физический смысл в области умеренно и сильно концентрированных растворов, не потеряла своей актуальности. Это, по-видимому, и побудило Бейтса совместно с Робинсоном и другими соавторами предложить в серии публикаций [23, 84-86] новый подход к решению этой проблемы, основанный на теории гидратации ионов Сток-са - Робинсона [ 22, гл. [24]
 |
Электролиты, требующие дополнительных исследований для установления стандартных значений химической активности ионов. [25] |
Таким образом, для ионов, указанных в табл. 3.35 и 3.36, стандартные шкалы ионной активности, охватывающие значительный интервал концентраций, могут быть построены уже теперь или в ближайшем будущем. [26]
Поскольку / в принято за 1 и /, равным / вне ( см. коэффициенты средней ионной активности, стр. К & Ка - Однако это неприменимо к кислотам, где соотношение между / ь и / Ае более сложно. [27]
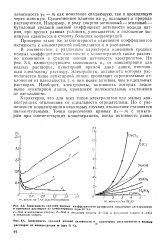
В соответствии с различным характером изменения средних ионных коэффициентов активности с концентрацией также различно изменяется и средняя ионная активность электролитов. На рис. 3.4, иллюстрирующем зависимость а от концентрации для водных растворов, пунктирной прямой дана линия, отвечающая идеальному раствору. Наоборот, электролиты, активность которых лежит выше пунктирной линии, проявляют положительные отклонения от идеальности. [29]
Фарадея; п - валентность иона; V - разность потенциалов между электродом и электролитом с ионной активностью a; km и ku - члены, выражающие влияние окружения иона соответственно в металле и растворе. Нернст рассмотрел процесс возникновения разности потенциалов между серебряным электродом и электролитом в результате перехода ионов серебра в раствор с образованием гидратированных ионов, при котором электроны остаются в металле. [30]
Страницы: 1 2 3 4