Оптическая активность - соединение
Cтраница 3
Поэтому представляются вполне естественными выводы о зависимости запаха от оптической активности соединений, к которым пришли И. Нав показал, что в некоторых тщательно проведенных исследованиях отмечается лишь различие интенсивности запахов антиподов. [31]
Показанный механизм рацемизации затрагивает только а-углеродный атом. Если в альдегиде или кетоне хиральным является иной атом, оптическая активность соединения кето-енольным превращением не затрагивается. [32]
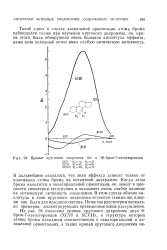 |
Кривые кругового дихроизма 6а - и бр-бром-7 - кетостероидов. [33] |
В дальнейшем оказалось, что знак эффекта зависит только от положения атома брома на октантной диаграмме. Когда атом брома находится в экваториальной ориентации, он лежит в плоскости симметрии кетогруппы и оказывает очень слабое влияние на оптическую активность соединения. В этом случае обычно амплитуда и знак кругового дихроизма остаются такими же, какими они были для исходного кетона. Ниже мы рассмотрим несколько примеров, иллюстрирующих приведенные выше рассуждения. [34]
На этих исследованиях мы остановимся более подробно, поскольку в свое время они способствовали накоплению фактического материала о зависимости запаха от оптической активности соединений и явились началом целенаправленного изучения запаха энантиомеров и рацемических соединений. [35]
Для циклических спиртов трудно сформулировать общее правило корреляции между знаком оптической активности и абсолютной конфигурацией, ввиду того что знак может меняться в зависимости от величины алкильной группы, присоединенной к ксантогенатной группировке. Все это, по-видимому, указывает на присутствие в равновесном состоянии приблизительно одинаковых количеств ротамеров. Значительно большая оптическая активность соединения IV6 наводит на мысль, что в этом случае преобладает один из ротамеров, так как атом серы связан с более объемистой группой. [36]
Как видно из изложенного выше, необходимы дальнейшие исследования для установления связи между запахом и оптической активностью соединений. Изучение оптических антиподов дает возможность для выделения из многочисленных факторов пространственного строения соединений единственного, а именно асимметричности строения молекул, и исследования его влияния на запах. Изучение зависимости запаха от оптической активности соединений представляется особенно важным ввиду идентичности физических и химических свойств антиподов. [37]
Соединения со скелетом бицикло [2,2,1] гептана встречаются в природе в оптически активном виде: это прежде всего борнеол и камфора. Доступность этих оптически активных соединений сделала их важными исходными веществами для получения асимметрических реагентов ( см. гл. В очень многих старых и современных работах изучается оптическая активность соединений этого ряда. [38]
Анализ результатов многочисленных исследований, проводившихся с целью установления связи между строением и запахом, позволяет сделать вывод, что до сих пор продолжается процесс накопления экспериментальных данных. Этот процесс, однако, является необходимой ступенью на пути к решению проблемы запаха, поскольку систематическое накопление новых данных о структуре соединений, обладающих запахом, расширит возможности для уточнения найденных и выявления новых закономерностей о взаимосвязи между строением и запахом. До настоящего времени остаются нерешенными многие вопросы, в частности, влияние на запах оптической активности соединений, экзо-экдо-изомерии и др. Необходимо продолжение исследований соединений, имеющих различное химическое строение, но одинаковый запах. [39]
Изомеры же ( а) и ( б), равно как изомеры ( в) и ( г), не-являются зеркальными. В них зеркально расположены атомы и группы только у одного из двух асимметрических атомов углерода. Подобного рода соединения, содержащие несколько асимметрических атомов углерода, но отличающиеся по пространственной конфигурации групп не у всех этих атомов и не являющиеся поэтому зеркально-построенными, называются диастереоизоме-рами. Поскольку оптическая активность соединений с несколькими асимметрическими атомами определяется суммарным влиянием всех этих атомов, диастереоиеомеры могут вращать плоскость поляризации в одном направлении, но с различной характерной для каждого из них величиной угла. [40]
Изомеры же ( а) и ( б), равно как изомеры ( 0) и ( г), не-являются зеркальными. В них зеркально расположены атомы и-группы только у одного из двух асимметрических атомов углерода. Подобного рода соединения, содержащие несколько асимметрических атомов углерода, но отличающиеся по пространственной конфигурации групп не у всех этих атомов и не являющиеся поэтому зеркально-построенными, называются диастереоизоме-рами. Поскольку оптическая активность соединений с несколькими асимметрическими атомами определяется суммарным влиянием всех этих атомов, диастереоивомеры могут вращать плоскость поляризации в одном направлении, но с различной характерной для каждого из них величиной угла. [41]
Легкость рацемизации оптически активных бифенилов определяется не только пространственными требованиями заместителей в opmo - положениях, о чем свидетельствует влияние пара-заместителей. Заместители в пара-положениях отстоят от центральной связи слишком далеко, чтобы принимать непосредственное участие в каких-либо пространственных взаимодействиях. Вопрос о том, почему нитрогруппа в пара-положении ( как в, соединении XL) вызывает увеличение оптической стабильности по сравнению с XXXIX, до настоящего времени не ясен. Увеличение оптической активности соединения XLI более понятно, поскольку можно ожидать, что же / па-нитрогруппа будет оказывать поддерживающее влияние на opmo - заместитель. Под этим имеется в виду то обстоятельство, что заместителю будет труднее отогнуться при повороте вокруг центральной связи. [42]
Легкость рацемизации оптически активных бифенилов определяется не только пространственными требованиями заместителей в opmo - положениях, о чем свидетельствует влияние пара-заместителей. Заместители в пара-положениях отстоят от центральной связи слишком далеко, чтобы принимать непосредственное участие в каких-либо пространственных взаимодействиях. Вопрос о том, почему нитрогруппа в пара-положении ( как в соединении XL), вызывает увеличение оптической стабильности по сравнению с XXXIX, до настоящего времени не ясен. Увеличение оптической активности соединения XLI более понятно, поскольку можно ожидать, что л ета-нитрогруппа будет оказывать поддерживающее влияние на орто-заме-ститель. Под этим имеется в виду то обстоятельство, что заместителю будет труднее отогнуться при повороте вокруг центральной связи. [43]
Приведенные выше заключения верны не только для ациклических, но также и для циклических соединений. Вицинально замещенные циклоалканы с любым напряжением цикла, имеющие идентичные заместители, аналогичны винным кислотам. Изомер является жезо-формой, оптически неактивной и нерасщепляемой; транс-изомер может существовать в правовращающей и левовращающей оптических формах и в виде рацемата. В этом случае оптическая активность соединения или возможность расщепления рацемата является однозначной проверкой транс-конфигурации заместителей в молекуле. [44]
Жирноароматические соединения легко нитруются в а-положение боковой цепи. Галогенпроизводные нитруются легче, чем соответствующий углеводород. Спирты и альдегиды в условиях реакций легко окисляются, давая главным образом кислоты. При замещении у асимметрического атома углерода оптическая активность соединения сохраняется. [45]
Страницы: 1 2 3 4