Химическая активность - элемент
Cтраница 2
В каждом отрезке - периоде повторяется характер изменения химических свойств в направлении ослабления основных и нарастания кислотных свойств элементов. При переходе от одного отрезка - периода к другому происходит сначала резкое исчезновение химической активности элемента ( инертный газ), затем столь же резкое возникновение металлических свойств. [16]
Вся химия благородных газов так или иначе связана с самым электроотрицательным элементом - фтором. Только с фтором могут взаимодействовать криптон, ксенон и радон, причем от криптона к радону химическая активность элементов возрастает. [17]
Зона В включает энергетические уровни, содержащие недостроенные ( недоукомплектованные), а также вакантные под ровни и орбитали. Характерная особенность зоны: наличие в ней неустойчивых электронных конфигураций, что при их переходе к более устойчивым конфигурациям и обусловливает химическую активность элемента. [18]
У каждого атома щелочных металлов электроны распределяются таким образом, что внешнюю оболочку занимает только один электрон. Поскольку при столкновении атомов в контакт вступают именно внешние электронные оболочки, то следует ожидать, что число электронов на внешней оболочке и определяет химическую активность элемента. Элементы с аналогичными внешними электронными оболочками имеют сходные свойства, как, например, вышеупомянутые щелочные металлы. [19]
Щелочные металлы, к которым относятся литий, натрий, калий, рубидий и цезий, входят в главную подгруппу I группы периодической системы. Имея во внешнем электронном слое по одному электрону ( после 2-электронного слоя у Li и 8-электронного предпоследнего слоя у Na, К, Rb, Cs), все они легко его отдают и являются энергичными восстановителями. Химическая активность элементов от Li к Cs возрастает. При нагревании на воздухе Na и К легко загораются, а рубидий и цезий на воздухе самовоспламеняются при обыкновенной температуре. Нормальные же окислы их получают косвенным путем - из перекисей. Все щелочные металлы при обыкновенной температуре бурно реагируют с водой, вытесняя из нее водород и образуя щелочи. [20]
 |
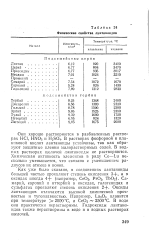
Физические свойства лантаноидов. [21] |
В растворах фосфорной и пла-зиковон кислот лантаноиды устойчивы, так как обра - 5уют защитные пленки малорастворимых солей. В водных растворах щелочей лантаноиды не растворяются. Химическая активность элементов в ряду Се-Lu не-жодько уменьшается, что связано с уменьшением радиусов их атомов и ионов. [22]
 |
Физические свойства лантаноидов. [23] |
В растворах фосфорной и плавиковой кислот лантаноиды устойчивы, так как образуют защитные пленки малорастворимых солей. В водных растворах щелочей лантаноиды не растворяются. Химическая активность элементов в ряду Се-Lu несколько уменьшается, что связано с уменьшением радиусов их атомов и ионов. [24]
В растворах фосфорной и плавиковой кислот лантаноиды устойчивы, так как образуют защитные пленки малорастворимых солей. В водных растворах щелочей лантаноиды не растворяются. Химическая активность элементов в ряду Се-Lu несколько снижается, что связано с уменьшением радиусов их атомов и ионов. [25]
На воздухе медь покрывается рыхлым слоем основных карбонатов, се. AgjS) от наличия сероводорода, в то время как золото не изменяется. Химическая активность элементов в подгруппе меди сверху вниз падает. Об этом свидетельствуют также закономерно возрастающие положительные значения стандартных электродных потенциалов. [26]
В растворах фосфорной и плавиковой кислот лантаноиды устойчивы, так как образуют защитные пленки малорастворимых солей. В водных растворах щелочей лантаноиды не растворяются. Химическая активность элементов в ряду Се - Lu несколько снижается, что связано с уменьшением радиусов их атомов и ионов. [27]
Щелочные, щелочноземельные металлы, Be и Mg относятся к наиболее электроположительным, элементам. С ростом числа электронных слоев и увеличением радиусов энергия ионизации атомов уменьшается. Вследствие этого химическая активность элементов в подгруппах увеличивается с ростом их порядкового номера. С малой энергией ионизации связан характерный для н х фотоэффект, а также бкрашивание их солями пламени газовой горелки. Благодаря легкой отдаче наружных электронов щелочные и щелочноземельные металлы образуют соединения преимущественно с ионной связью. [28]
Щелочные, щелочноземельные металлы, Be и Mg относятся к наиболее электроположительным, элементам. С ростом числа электронных слоев и увеличением радиусов энергия ионизации атомов уменьшается. Вследствие этого химическая активность элементов в подгруппах увеличивается с ростом их порядкового номера. С малой энергией ионизации связан характерный для них фотоэффект, а также окрашивание их солями пламени газовой горелки. Благодаря легкой отдаче наружных электронов щелочные и щелочноземельные металлы образуют соединения преимущественно с ионной связью. [29]
В V группе, наоборот, второй типический элемент ( фосфор, особенно белый) более активен как гомоатомное соединение, чем азот. Поэтому на химическую активность элемента ( атома) решающее влияние оказывает энергия диссоциации гомоатомных соединений на атомы. Это обстоятельство является основной причиной большей химической активности фосфора по сравнению с азотом. В то же время атомы азота, естественно, химически гораздо активнее атомов фосфора. Таким образом, когда речь идет о большей химической активности фосфора по сравнению с азотом, нужно иметь в виду активность гомоатомных соединений. Несмотря на имеющиеся различия между азотом и фосфором, оба типических элемента и их производные - важнейшие составные части растительных и животных организмов. [30]
Страницы: 1 2 3