Простой алкан
Cтраница 1
Простые алканы являются наиболее слабыми из углеводородных кислот. Известны многочисленные примеры металлирования ароматических углеводородов алкильными солями щелочных металлов; обратная реакция в заметной степени не происходит. [1]
Хлорирование простых алканов, однако, редко используют для получения монохлорпроизводных, так как первоначально образовавшийся продукт подвергается дальнейшей атаке очень реакционноспособным хлором, что приводит к образованию сложной смеси продуктов. [2]
В случае простых алканов С Нт величина стандартной теплоты образования может быть определена, если известна теплота сгорания алкана в углекислоту и воду. [3]
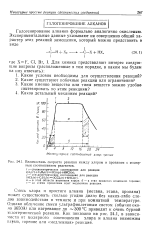 |
Взаимосвязь скорости реакции между хлором и пропаном с молярным соотношением реагентов. [4] |
Смесь хлора и простого алкана ( метана, этана, пропана) может существовать сколько угодно долго без каких-либо следов взаимодействия в темноте и при комнатной температуре. Однако облучение смеси ультрафиолетовым светом ( обычно около 3650А) или нагревание до - 300 С приводит к очень бурной экзотермической реакции. Как показано на рис. 24.1, в зависимости от молярного соотношения хлора и алкана возможны взрыв, горение или медленная реакция. [5]
Многие из бром - и иодсодержащих простых алканов также были найдены в морских водорослях. [6]
Кажущийся успех квазиравновесной теории в расчетах масс-спектров простых алканов в настоящее время представляется отчасти случайным, так как становится все более очевидным, что структуры молекулярных ионов алканов не совпадают со структурами основных состояний тех молекул, при ионизации которых они получены. Отщепление 13СН3 от пропана-2 - 13С [12] и меченого СН3 из неконцевых положений н-гексана [13] является веским аргументом в пользу неклассических структур распадающихся ионов, которые, несомненно, отличаются от структуры исходных молекул. Эти явления хорошо согласуются с расчетами систем с незаполненными оболочками, выполненных методом молекулярных орбиталей ( разд. Они показывают, что успех квазиравновесной теории масс-спектров алканов определяется просто удачным подбором параметров. [7]
 |
Алкильные группы и простые алканы. [8] |
Эта система начала развиваться только после того, как ряд наиболее простых алканов получил тривиальные или несистематические названия. [9]
Первая стадия переноса цепи, которая, по крайней мере в случае простых алканов, контролирует скорость развития цепи, состоит в атаке атома хлора на молекулу алкана, отрыве атома водорода и образовании алкильного радикала. [10]
Однако интермедиа 6 и 10 представляют собой особые примеры типа алкилплатинового интерме-диата, предложенного [1, 2] для обмена Н-2 Н в простых алканах, которые, конечно, не содержат координирующегося енового или фосфинового заместителя. [11]
Четвертый подкласс, получение углерода и водорода, состоит из групп: 15 - отщепление одного атома углерода и молекулы водорода от алканов и образование более простого алкана; 16-расщепление алканов на водород, углерод и метан; 17 - частичное разложение алкенов до углерода, водорода и метана, а также 18 - полное термическое разложение алканов, 19 - алкенов, 20 - алкинов и 21 - диенов. [12]
Хасса с сотрудниками [31, 32] и результатам исследований Броуна и Рассела [34] и других авторов [35], атомы водорода, связанные с первичными атомами углерода, во всех простых алканах приблизительно в 100 раз более реакционноспособны, чем в метане. [13]
У следующих алканов изомеров еще больше и, естественно, возникла проблема - как все их называть. Простым алканам ( и вообще органическим веществам) давали случайные или, как говорят, тривиальные названия. Но веществ обнаруживалось и существует очень много, а их все не запомнить. [14]
Одной из таких структурных особенностей является присутствие групп, обладающих отрицательным индуктивным эффектом. Подобно атомам углерода простых алканов, углеродный атом в голове моста в триптицене ( 26) является приблизительно тетраэдрическим. В анионе орбиталь, несущая заряд, ортогональна к трем ароматическим я-системам, так что делокализация заряда с помощью резонанса невозможна. [15]
Страницы: 1 2