Ковалентный комплекс
Cтраница 2
Сэндвичевая структура является самой устойчивой не только для ковалентных комплексов, использующих d - орбитали, но н для ионных кристаллов - для катиона и двух отрицательно заряженных циклов. Интересно и необычно строение комплекса бериллия. Малый по размерам ион Ве2 поляризует я-облако одного цикла, и образуются энергетически выгодные короткая ковалентная связь и длинная ионная связь. [16]
Таким образом, ТКП применима в случае ионных комплексов, МВС - в случае ковалентных комплексов. Применение ММО не зависит от типа химической связи. [17]
Таким образом, ТКП применима в случае ионных комплексов, МВС - в случае ковалентных комплексов. Применение МАЮ не зависит от типа химической связи. [18]
Поэтому и ионных соединениях атом Fe111 будет иметь момент равный 5 86, а в ковалентных комплексах - равный только 1 73 магнетона Бора. У KsFeIn ( CN) e наблюдавшийся момент равен 2 33, что указывает на ковалентные связи, а у комплексов, содержащих F или Н20 ( в ( NH4) 3FeFe, ( NH4) [ FeF5 ( H3O) ]), он равен 5 9 магнетонов Бора. Аналогичные рассуждения, примененные к комплексам трехвалентного кобальта, приводят к выводу, что [ СоРв ] 3 - и [ Со ( Н20) 0 ] зн содержат ионные связи, а [ Со ( NH3) 6pJ -, [ Co ( NO2) 0 ] 3 - и [ Со ( СМ) 6р - - ковалентные связи. В этих случаях число неспаренных электронов равно четырем в ионной связи и нулю в ковалентной связи. [19]
Для тетраэдрических комплексов и комплексов, орбиты центрального иона которых сильно смешаны с орбитами лигандов ( ковалентные комплексы), необходимо применять более общую теорию поля лигандов. Теория кристаллического поля может дать только качественные результаты. [20]
Если при этом центральный ион характеризуется сравнительно невысоким потенциалом ионизации, то он не может образовать прочных ковалентных комплексов. Совершенно аналогично и адденды, характеризующиеся большим электронным сродством, не склонны к образованию прочных ковалентных комплексов. [21]
При этом условии таким образом можно рассмотреть и взаимодействие бинарных соединений с простыми веществами, приводящее к образованию ковалентных комплексов, например карбонилов. [22]
Этот раздел посвящен краткому описанию очень интересного класса гомогенных катализаторов, в который входят карбонилы металлов и ряд родственных ковалентных комплексов, содержащих металл-углеродные связи. Например, дикобальтоктакарбонил является катализатором для присоединения водорода к олефиновым связям и для гидрогенолиза спиртов, в то время как каталитическая активность ионов металлов обычно проявляется лишь при реакции водорода с веществами, которые легко восстанавливаются обратимыми донорами электронов. С другой стороны, относительно большая сложность этих катализаторов вызывает большие трудности при установлении их структуры и механизма действия. [23]
Из щелочноземельных металлов только Be2 1 и в некоторой степени Mg2 функционируют как достаточно сильные акцепторы электронов, образуя довольно слабые ковалентные комплексы. [24]
Очевидно, первый из этих комплексов ( неустойчивый) является ионным, а второй ( особо устойчивый) - ковалентным комплексом. На основании таких измерений межатомных расстояний ковалентные комплексы называют также комплексами внедрения. [25]
Третья классификация подразделяет эти комплексы на две группы: высокоспиновые и низкоспиновые, что соответствует по сути дела полинговскому делению на ионные и ковалентные комплексы; эта классификация обладает тем преимуществом, что не постулирует заранее тип связи. [26]
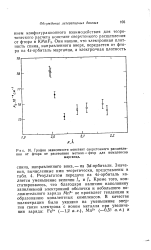 |
График зависимости констант сверхтонкого расщепления от фтора от расстояния металл - фтор для комплексов. [27] |
Кроме того, констатировалось, что благодаря наличию наполовину заполненной электронной оболочки и небольшого положительного заряда Мп2 не проявляет тенденции к образованию ковалентных комплексов. [28]
Во многих случаях вопрос, является ли комплекс переходного элемента ковалентным или ионным, решался на основе его магнитных свойств: в ковалентных комплексах число неспаренных электронов меньше, чем в свободном ионе металла. В настоящее время считают, что в действительности оба типа комплексов образованы при участии ковалентной связи, но в то время как первые используют внутренние d - орбитали, например d2sp3, вторые используют внешние орбитали того же главного квантового числа, что и s - и р-орбитали. Менее обязывающие названия комплексов этих двух типов - низкоспиновые и высокоспиновые - кажутся более предпочтительными. [29]
Ионы, ассоциированные в пары, имеют почти те же инфракрасные или рамановские спектры, что и сольватиро-ванные ионы в растворе, но спектры ковалентных комплексов резко отличны от них. В расчетах равновесий обычно нет необходимости проводить различия между ионными парами и ковалент-ными комплексами. [30]
Страницы: 1 2 3 4