Изученный комплекс
Cтраница 4
В недавно опубликованной работе А. И. Кульбиды и В. М. Шрайбера ( см. ссылку [8] в Предисловии к наст, сб. Это означает, что подвижность молекул растворителя является необходимым условием перехода протона в изученных комплексах и что учет вклада межмолекулярных координат в координату реакции является обязательным. Конкретный механизм этого влияния остается пока невыясненным. [46]
Это означает, что подвижность молекул растворителя является необходимым условием перехода протона в изученных комплексах и что учет вклада межмолеку-лярных координат в координату реакции является обязательным. Конкретный механизм этого влияния остается пока невыясненным. [47]
Конечно, наиболее активными частицами являются свободные атомы, и в последнее время большой интерес вызывает исследование их взаимодействия с матричным веществом. Именно этим способом получены в матрице карбонильные комплексы металлов М ( СО) Х и недавно изученные комплексы M ( N2) x: и М ( 02) х некоторые примеры приведены в гл. [48]
Пока известен только один пример переноса алкильной группы от тетраалкилбората к карбонильной группе. Стереохимия реакции та же, что и в случае других ат-комплексов, но бораты наименее реакционноспособны из всех изученных комплексов. Реакция с ацилхлоридами схема ( 12) идет гладко и приводит к кетонам без примеси третичного спирта [30, 31], поскольку бораты инертны по отношению к кетонам. [49]
Рассмотрение найденных величин приводит к следующим основным выводам. Все изученные соединения могут быть расположены в ряд по величинам констант нестойкости. Все пока изученные комплексы тетраминового типа совмещают высокую термодинамическую прочность с большой инертностью. Для комплексов платинитного типа характерно противопоставление термодинамической прочности и кинетической лабильности. Комплексные ионы с близкими значениями констант могут очень сильно отличаться по кинетической лабильности. По ряду Вернера - Миолати для производных PtCl2 наблюдается закономерное увеличение термодинамической прочности по мере увеличения числа координированных молекул аммиака. [50]
 |
Кратности связей в канонических формах нитроароматических соединений в соответствующих им 4-нитроциклогексадиенатных сг-комплексах. [51] |
Поскольку при переходе от 83 к 84 кратность двух связей N - О уменьшается, а возрастает кратность только одной связи N - С, частота симметричного поглощения также должна уменьшаться. Действительно, такое уменьшение наблюдалось для всех изученных комплексов. При добавлении цианида в хлороформный раствор 1 3 5 - ТНБ уменьшается симметричное и антисимметричное поглощение нитрогруппы и одновременно появляются два новых пика при 1235 и 1190 см 1 с аналогичными коэффициентами экстинкции. [52]
Если реакции этого типа приводят к образованию хорошо изученных комплексов, охарактеризованных со стереохимической точки зрения, то их можно использовать для определения строения комплексов. Расщеплению оловых соединений до одноядерных способствует нагревание в кислой среде. [53]
Важнейшим проявлением специфики электронного строения и вытекающих отсюда химических свойств платиновых элементов является их склонность к образованию комплексных соединений. Элементы-металлы других групп периодической системы, особенно поливалентные элементы переходных рядов, также дают комплексные соединения той или иной устойчивости практически со всеми известными лигандами. Спецификой комплексных соединений платиновых элементов и прежде всего наиболее изученных комплексов платины и палладия является высокая прочность ковалентной связи, обусловливающая кинетическую инертность этих соединений. Последнее даже делает невозможным определение обычными методами такой важной характеристики комплекса, как его Куст - Обмен лигандами внутри комплекса и с лигандами из окружающей среды также затруднен. Это позволяет конструировать, например, октаэдрические комплексы платины ( IV), в которых все шесть лигандов различны. Такие системы могут существовать без изменения во времени состава как в растворах, так и в твердом состоянии. [54]
Вместе с тем сообщается также, что смесь SnCl4 и PSC13 дает широкие сигналы, центрированные у частот линий чистых исходных веществ, что свидетельствует об отсутствии комплексообразования. Установление центра координации может осуществляться на основе обсуждения наблюдаемых значений сдвигов: в комплексе СН3ОСН2С1 SnCl4 состава 2: 1 перенос заряда происходит через атом кислорода хлорэфира; в комплексе С6Н5СН2С1 SnCl4 в переносе заряда, вероятнее всего, участвует атом хлора донорной молекулы [126], тогда как в комплексе C6H5NO2 - SnCl4 роль донорных центров играют два атома кислорода. Большинство изученных комплексов, содержащих олово, может быть отнесено к сильным комплексам, поскольку сдвиг частоты ЯКР при переходе от комплекса к незакомплексованным веществам намного превышает обычно ожидаемый эффект кристаллического поля. [55]
Хотя темновая проводимость обнаруживает примесный характер, по-видимому обусловленный наличием частиц М ( акцептор), где М - примесный ион, например ион натрия, фотопроводимость имеет беспримесный характер, присущий самому комплексу. Рассмотрение кристаллических структур изученных комплексов подтвердило, что указанные условия выполняются для комплексов хризен - TCNQ и тетрабензонафталин - TCNQ, в которых также обнаружена максимальная фотопроводимость. [56]
Согласно принципу перекрывания и ориентации Малликена [115], взаимная ориентация донорной и акцепторной молекул должна обеспечивать наиболее эффективное перекрывание орбиталей, вовлеченных во взаимодействие с переносом заряда. Праут и Райт [128], а также Майо и Праут [106] подробно исследовали эту проблему и пришли к выводу, что относительная ориентация донорной и акцепторной молекул возникает в результате компромисса между требованиями максимальной стабилизации при переносе заряда и диполь-дипольном взаимодействии или образовании водородной связи, причем только при небольшой ориентационной зависимости этих более сильных взаимодействий реализуется максимальное орбитальное перекрывание. В 19 из 29 изученных комплексов с переносом заряда установлено достижение 80 - 100 % максимальной энергии стабилизации; в других комплексах, где требования дипольного взаимодействия или образования водородной связи могли конкурировать с принципом максимального перекрывания, обнаружена меньшая стабилизация при переносе заряда или вообще отсутствие стабилизации. [57]
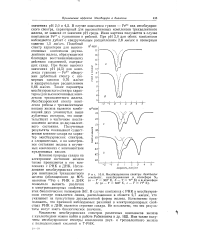 |
Мессбауэровские спектры Azotobacter. [58] |
В случае комплекса гуанин - Fe3 вид мессбауэров-ского спектра, характерный для высокоспиновых комплексов трехвалентного железа, не зависел от значения рН среды. Иная картина получается в случае комплексов Fe3 с гуанозином и рибозой. При рН 2 0 для обоих комплексов наблюдается дублет с квадрупольным расщеплением 2 8 мм / сек и изомерным сдвигом 1 5 мм / сек. Подобный спектр характерен для высокоспиновых комплексов двухвалентного железа, образующегося благодаря восстанавливающему действию соединений, содержащих сахар. При более высоких значениях рН ( 4 5) для комплекса гуанозин - Fe3 обнаружен дублетный спектр с изомерным сдвигом 0 76 мм / сек и квадрупольным расщеплением 0 66 мм / сек. Такие параметры мессбауэровского спектра характерны для высокоспиновых комплексов трехвалентного железа. Мессбауэровский спектр комплекса рибозы с трехвалентными ионами железа является комбинацией двух упомянутых выше дублетных спектров, что свидетельствует о частичном восстановлении железа до двухвалентного состояния. Полученные результаты показывают существенное влияние сахара на характер мессбауэровских спектров, а следовательно, и на электронное состояние железа в изученных комплексах с компонентами нуклеиновых кислот. [59]
Страницы: 1 2 3 4