Аммиачный комплекс - медь
Cтраница 1
Аммиачный комплекс меди при подкислении разрушается вследствие связывания молекулы NH3 ионами Н с образованием более устойчивого комплекса ( ср. Подобное же разрушение комплекса [ Cu ( NH3) J вызывает действие H2S, поскольку концентрация ионов Си 1 в растворе оказывается достаточной для превышения произведения растворимости CuS, который выпадает при этом в осадок. [1]
Аммиачный комплекс меди разрушают соляной кислотой, набираемой в микропипетку из конуса с изогнутой ножкой. [2]
Аммиачные комплексы меди и никеля окрашены в синий цвет, комплекс Со ( Ш) - темно-бурого цвета. [3]
Аммиачный комплекс меди разрушают соляной кислотой. [4]
Аммиачные комплексы меди ( II) не разрушаются щелочами. Гидроксид меди ( II) растворяется в аммиаке. Комплексы меди ( II) разрушаются H2S - выпадает осадок CuS. В концентрированных растворах СиС12 образуется зеленый комплекс. [5]
Хотя аммиачный комплекс меди имеет при достаточной концентрации резко выраженную синюю окраску, однако, как показывает опыт, чувствительность глгаза в синей области спектра невелика, поэтому колориметрический метод не может служить для определения следов меди. [6]
При подкислении аммиачный комплекс меди разрушается вследствие связывания молекулы NH3 ионами Н с образованием более устойчивого комплекса ( ср. Подобное же разрушение комплекса [ Cu ( NH3) 4 ] имеет место при действии H2S, поскольку концентрация ионов Си в растворе оказывается достаточной для превышения произведения растворимости CuS, который выпадает при этом в осадок. [7]
При подкислении аммиачный комплекс меди разрушается вследствие связывания молекул NHg ионами Н с образованием более устойчивого комплекса NH4 ( ср. Разрушение комплекса [ Cu ( NH3) J происходит также при действии H2S, поскольку концентрация ионов Си в растворе оказывается достаточной для превышения произведения растворимости CuS, который выпадает при этом в осадок. [8]
При термолизе аммиачного комплекса меди возможно протекание окислительно-восстановительных процессов, гидролиза с конечным образованием Си ( ОН) 2 или продукта его дегидратации СиО и аммиаката одновалентной меди. При комплексонной обработке в питательной воде, кроме аммиаката меди возможно присутствие и аммиачной соли ЭДТАцетата меди ( NH CuY. При термолизе раствора ( NH4) 2CuY pH8 4 в стендовых условиях [5.5] при температуре 200 С в растворе оставалось 2 % Си, в осадке определена металлическая медь. [9]
Раствор, содержащий аммиачные комплексы меди и кадмия, подкисляют 2 и. Подготовленный таким образом прозрачный раствор насыщают сероводородом. Невыпадение осадка может явиться следствием относительно большой кислотности раствора. [10]
В отличие от аммиачных комплексов меди, в этом случае ион меди присоединяет к себе не нейтральные молекулы, а ионы ОН -, вследствие чего образуются комплексные анионы, а не катионы. [11]
В отличие от аммиачных комплексов меди, в этом случае ион меди присоединяет к себе не нейтральные молекулы, а ионы ОН -, вследствие чего образуются комплексные анионы, а не катионы. Куприты очень нестойки и при разбавлении щелочных растворов водой разлагаются, выделяя гидроксид меди ( II) в осадок. [12]
В отличие от аммиачных комплексов меди, в этом случае ион меди присоединяет к себе не нейтральные молекулы, а ионы ОН -, вследствие чего образуются комплексные анионы, а не катионы. Куприты очень нестойки и при разбавлении щелочных растворов водой разлагаются, выделяя гидроксид меди ( П) в осадок. [13]
В отличие от аммиачных комплексов меди, в этом случае ион меди присоединяет к себе не нейтральные молекулы, а ионы ОН -, вследствие чего образуются комплексные анионы, а не катионы. Куприты очень нестойки и при разбавлении щелочных растворов водой разлагаются, выделяя гидроксид меди ( И) в осадок. [14]
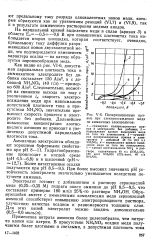 |
Поляризационные кривые при электроосаждении меди из аммиачных электролитов. [15] |
Страницы: 1 2 3 4