Комплексообразование - ион - металл
Cтраница 2
В заключение укажем, что экстракция хелатов может быть использована как метод изучения комплексообразования ионов металла в водных растворах. Если в [ растворе образуется какой-либо недиссоциируемый комплекс Меи с лигандом В ( МеВт), то это обстоятельство сказывается в понижении коэффициента распределения данного элемента. [16]
Примером реакций, протекающих по схеме ( VIII, 198), может служить комплексообразование иона металла М с лиган-дом В при одновременном наличии гидролиза. [17]
Основной вывод, вытекающий из этой работы и работы [6], заключается в том, что комплексообразование ионов металлов с арсеназо I, связанное с замещением протонов сопряженных групп, смещает таутомерное равновесие системы в сторону азоформы. [18]
Комплексонометрическим титрованием ( комплексономет-рией) называют титриметрический метод количественного анализа, основанный на аналитическом использовании реакций комплексообразования ионов металлов с полидентат-ными хелатообразующими органическими аналитическими реагентами - комплексонами. [19]
Исходя из этого, Бендер считает, что максимальный каталитический эффект в этих реакциях можно получить при непосредственном комплексообразовании иона металла с субстратом. [20]
В связи с этим на кривых светопоглощения растворов комплексов, обладающих зеленой окраской, имеется по два максимума: один из них, более высокий, в области - 665 ммк, обусловленный образованием хинонгидра-зонной хромофорной системы, и другой - в области - 610 ммк, обусловленный комплексообразованием иона металла со второй половиной молекулы арсеназо III, находящейся в азоформе. [21]
В связи с этим на кривых светопоглощения растворов комплексов, обладающих зеленой окраской, имеется по два максимума: один из них, более высокий, в области - 665 ммк, обусловленный образованием хинонгидра-зонной хромофорной системы, и другой - в области - - 610 ммк, обусловленный комплексообразованием иона металла со второй половиной молекулы арсеназо III, находящейся в азоформе. [22]
 |
Комплексообразование ионов меди с аммиаком. [23] |
Рассмотрим соответствие реакций комплексообразования ионов металлов с неорганическими и органическими лигандами перечисленным выше требованиям. [24]
В области рН от 6 до 8 коэффициент релаксационной эффективности ионов железа ( III) при совместном присутствии обоих лигандов ниже соответствующего значения в присутствии одного из лигандов, что служит прямым указанием накопления в данной системе новой комплексной частицы, которой может быть только камплекс с указанными разнородными лигандами. Различие в значениях КРЭ для простых и смешанных комплексов может быть использовано для исследования реакции комплексообразования ионов металлов с разнородными лигандами. [25]
Эта задача могла быть решена использованием метода амперометрического титрования, который позволяет широко применять реакции комплексообразования ионов металлов с органическими реагентами. Особенно ценными среди последних являются реагенты-деполяризаторы, к которым относятся БФГА и его аналоги. [26]
Состояние элементов в поверхностных водах обусловлено сложной совокупностью взаимодействий органических и неорганических веществ, содержащихся в воде. Теоретически его можно описать с помощью систем уравнений, составленных на основе данных о содержании в водах отдельных компонентов и количественных характеристик реакций гидролиза, полимеризации и комплексообразования ионов металлов с неорганическими и главным образом природными органическими лигандами, а также количественных характеристик реакций диссоциации, обратимой и необратимой ассоциации растворенных органических веществ. Необходимые для расчетов равновесий в водах количественные данные, имеющиеся в литературе, весьма ограниченны. Существуют и принципиальные математические трудности в решении этих задач для многокомпонентных систем. [27]
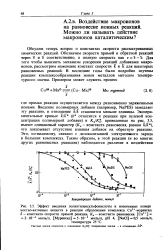
Обсудим теперь вопрос о константах скорости рассматриваемых химических реакций. Для того чтобы выяснить механизм ускорения реакций добавками макроионов, рассмотрим изменение констант скорости 5 и К для некоторых равновесных реакций. В последние годы были подробно изучены реакции комплексообразования ионов металлов методом температурного скачка. [29]
Кроме того, полнота образования комплексного соединения часто зависит от рН раствора. Оптимальное значение рН образования комплекса должно быть предварительно установлено ( см. стр. Обычно для этого используют буферные растворы. При выборе буферного раствора необходимо, чтобы комплексообразование иона металла с компонентами буферного раствора отсутствовало. Для получения воспроизводимых результатов ионная сила раствора также должна быть постоянной. [30]
Страницы: 1 2 3