Металлический катализатор
Cтраница 2
Металлические катализаторы часто наносятся на носитель или про-мотируются неметаллическими добавками. В большинстве случаев роль этих добавок и носителей сводится к увеличению поверхности металла и предохранению его от рекристаллизации. Имеются, однако, отдельные указания на более специфичное действие добавок. Наиболее подробно в этом отношении изучены железные катализаторы синтеза аммиака. [16]
Металлические катализаторы часто готовят путем нанесения металла на носитель. Взаимосвязь металла с носителем и дисперсность металла являются важными объектами для изучения катализаторов, так как это сказывается на каталитическую активность и селективность катализаторов. [17]
Металлический катализатор обычно вводят в систему в виде окислов низшей валентности; под действием гидроперекиси он окисляется до высшей валентности. На стадии, когда протекают реакции ( 111) и ( 112), начинается заметное расходование кислорода, и цвет реакционной смеси изменяется [96] - при применении кобальта из розового в темно-коричневый. Цвет двухвалентного иона кобальта розовый, а трехвалентного - зеленый. Таким образом, очевидно, что в реакционной смеси присутствуют ионы двух - и трехвалентного кобальта. [18]
Металлические катализаторы могут инициировать окисление и при непосредственном взаимодействии с углеводородами. Например, реакция солей трехвалентного кобальта с олефинами может проходить относительно быстро при комнатной температуре. [19]
Металлические катализаторы, осажденные на угле, по мнению Адкинса и Ингленда [2], в этом отношении относительно безопасны. Как установили Адкинс и Ингленд, при дегидрировании 2 2 3-триметилтетралина в присутствии платинированного угля при 350 - 375 С образуется с 80 % - ным выходом 2 3-диметилнафта-лин и только следы 1 2 3-триметилнафталина, в то время как никель на кизельгуре дает - 40 % триметилнафталина. Так как никель на хромите никеля по своему действию занимает промежуточное положение, то, вероятно, степень миграции зависит скорее от носителя, чем от металла. Возможно, что активные центры некоторых носителей способствуют перегруппировке независимо от самого процесса каталитического дегидрирования. [20]
Металлические катализаторы, особенно платина, палладий и никель, не имеют специфической способности к адсорбции полярных соединений и функциональных групп, и на их поверхности легче протекает адсорбция реагента по углерод-углеродным связям. Наоборот, оксидные катализаторы, имеющие полярную кристаллическую решетку, обладают специфической сорбционной способностью к полярным группам органических веществ. Полифункциональное соединение при адсорбции на поверхности оксидного катализатора оказывается opi ентированным по полярной группе, в связи с чем ненасыщенные и ароматические альдегиды, кетоны, карбоновые кислоты, нитро соединения и другие вещества гидрируются на оксидных катализаторах преимущественно по кислородсодержащим группам с сохранением ненасыщенных или ароматических связей. [21]
Металлические катализаторы, такие, как CuO, Cr2O3, Fe2O3, MnO2 и КМпО4, повышают порог горения ПХА по давлению, тогда как разлагающиеся соли аммония ( такие, как NH4C1) ингибируют горение ПХА. Каталитическое действие солей металлов на связующее, как правило, сводится к ускорению окисления НС. Что касается твердых топлив, то скорость их горения возрастает при добавлении в рецептуру Fe2O3, производных ферроцена, хромата меди и других соединений переходных металлов. Существуют разные точки зрения на механизм каталитического действия этих присадок, поскольку катализаторы могут оказывать влияние на реакции в газовой фазе, на подповерхностные реакции в твердой фазе и на реакции на поверхности как по отдельности, так и одновременно. Известно, что эффективность катализатора меняется в зависимости от его типа, концентрации, размера его частиц и давления. [22]
Металлический катализатор может быть также получен адсорбцией карбонила металла активированным углем и последующим термическим разложением карбонила с образованием активного металла. На никелевых катализаторах образуются значительно большие количества кристаллического полиэтилена высокого молекулярного веса, чем на кобальтовых. [23]
Металлические катализаторы очень чувствительны к ка-тализаторным ядам, особенно к серо - и галогенсодержащим веществам. [24]
Металлические катализаторы в основном получают восстановлением окислов, иногда солей металлов, приготовленных описанными выше способами. Восстановление производят водородом, чаще всего в контактном аппарате. [25]
Металлические катализаторы ( никель, кобальт, медь и железо) обычно - получают термическим разложением их солей и последующим восстановлением. Для этой цели используют нитраты и хлориды, а также соли органических кислот ( форми-аты, оксалаты и ацетаты), которые разлагаются при сравнительно низких температурах. Образующиеся окислы восстанавливаются самопроизвольно до металлов за счет создающейся при разложении солей восстановительной среды. [26]
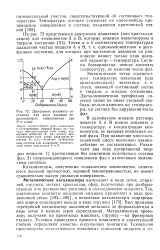 |
Диаграмма фазового состояния для двух взаимно нерастворимых компонентов при Р const. [27] |
Металлические катализаторы выпускают в виде сеток, спиралей, стружки, мелких кристаллов, сфер, полученных при разбрызгивании или распылении расплава в охлаждающую жидкость. Металлическую проволоку получают на протяжных машинах, стружку - на фрезерных станках. Условия проведения процесса плавления в значительной степени определяют качество получаемых контактов. [28]
Металлические катализаторы, в том числе и смешанные, весьма чувствительны к каталитическим ядам, которыми являются соединения, содержащие серу или галоген. Особенно легко отравляется медный катализатор, поэтому нитро - ы питрозосо единения предварительно очищают от примесей. В ряде случаев применяют комбинации катализаторов, которые обеспечивают разложение сернистых соединений с образованием продуктов, не отравляющих катализатор. [29]
Металлические катализаторы ( никель, кобальт, медь и железо) обычно приготовляются из солей металлов путем термического их разложения и последующего восстановления образующихся окислов. Для этой цели используют нитраты и хлориды, а также соли органических кислот ( формиаты, оксалаты и ацетаты), которые разлагаются при сравнительно низких температурах. Образующиеся окислы восстанавливаются самопроизвольно до металлов за счет создающейся при разложении солей восстановительной среды. [30]
Страницы: 1 2 3 4