Кинетика - распад
Cтраница 3
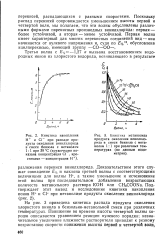
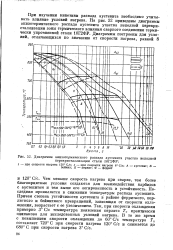 |
Диаграмма анизотермического распада аустенита участка неполной перекристаллизации стали 10Г2ФР. [31] |
При изучении кинетики распада аустенита необходимо учитывать влияние условий нагрева. [32]
Сведения о кинетике распада первично образующихся гидроперекисей имеют большое значение и для изучения последовательности образования продуктов окисления. [33]
В настоящей работе кинетика распада ГГЩ в алифатических и циклоалифатических углеводородах сопоставлена с кинетикой выделения кислорода в этих условиях и с данными по распаду ее в присутствии ингибитора. [34]
Шварц при изучении кинетики распада принимает е2 66 ккал. Полагая / 10 - 4 и ( RH) 1017 ( опыты Шварца [20] проводились при Р - 6 - 8 мм рт. ст.), получаем, что скорости становятся равными при температуре 900 С. В действительности уже при 800 в основном идет процесс распада пропилена. Следует отметить, что значение величины энергии отрыва атома Н от радикала С3Н5, принятое нами равным 66 ккал, вероятно, завышено, так как энергия отрыва атома Н от двойной связи ( С2Н4) равна 104 ккал, а энергия образования двойной связи вряд ли может быть меньше 50 ккал. [35]
Шварц при изучении кинетики распада принимает е266 ккал. В действительности уже при 800 С в основном идет процесс распада пропилена. [36]
Своеобразно влияют на кинетику распада такие сильные карбидообразо-ватели, как V, Ti, Mb и отчасти W. Так как эти элементы образуют труднорастворимые карбиды, то при обычных температурах закалки ( 800 - 900) они остаются связанными в карбиды и не переходят в аустенит. [37]
 |
Влияние легирующих элементов на температуру мартенситного превращения ( а и количество остаточного аустенита ( б. Стали содержат 1 % С ( В. Д. Садовский. [38] |
Своеобразно влияют на кинетику распада такие сильные карбидо-образователи, как V, Ti, Nb и отчасти W. Так как элементы образуют труднорастворимые карбиды, то при обычных температурах закалки ( 800 - 900 С) они остаются связанными в карбиды и не переходят в аустенит. В результате этого прокаливаемость стали уменьшается, так как карбиды действуют как готовые центры кристаллизации перлита. При высоком нагреве под закалку эти карбиды уже растворяются; аустенит содержит эти элементы в растворе, что увеличивает прокаливаемость. [39]
Своеобразно влияют на кинетику распада такие сильные карбидообразователи, как ванадий, титан, ниобий и частично вольфрам. Так как эти элементы образуют труднорастворимые карбиды, то при обычных температурах закалки ( 800 - 900 С) они остаются связанными в карбиды и не переходят в аустенит. В результате этого прокаливаемость стали уменьшается, так как карбиды действуют как готовые центры кристаллизации перлита. При высокой температуре нагрева под закалку эти карбиды уже растворяются; аустенит содержит эти элементы в растворе, что увеличивает прокаливаемость. [40]
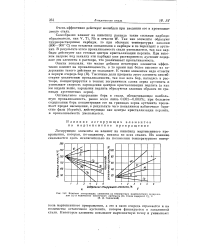
 |
Диаграмма анизотермического распада аустенита стали 10Г2ФР в условиях непрерывного охлаждения при сварке. [41] |
Показанные различия в кинетике распада аустенита двух основных участков зоны термического влияния и конечных результатов превращения ( обобщенных структурными диаграммами) определяются состоянием аустенита, которое формируется на стадии нагрева. [42]
Как уже отмечалось, кинетика распада перекисей во многих случаях определяется природой растворителя. Ускорение распада перекисей под влиянием растворителей в большинстве случаев, по-видимому, можно рассматривать как частный мало эффективный случай окислительно-восстановительного активирования, причем малая эффективность системы обусловлена слабыми восстановительными свойствами среды. Бимолекулярные реакции перекисей или гидроперекисей со многими соединениями представляются в ряде случаев энергетически более выгодными, чем термич. [43]
Как уже отмечалось, кинетика распада перекисей во многих случаях определяется природой растворителя. Ускорение распада перекисей под влиянием растворителей в большинстве случаев, по-видимому, можно рассматривать как частный мало эффективный случай окислительно-восстановительного активирования, причем малая эффективность системы обусловлена слабыми восстановительными свойствами среды. Бимолекулярные реакции перекисей или гидроперекисей со многими соединениями представляются в ряде случаев энергетически более выгодными, чем термич. [44]
Страницы: 1 2 3 4