Константа - скорость
Cтраница 2
Константа скорости постоянна в пределах неизбежных ошибок опыта, следовательно, эта реакция является реакцией первого порядка. Константа скорости реакции омыления этилового эфира уксусной кислоты едким натром при 283 К равна 2 38, если концентрацию выражать в кмоль / м3, а время - в минутах. [16]
 |
Константы скорости дейтерообмена замещенных галоид-бензолов. [17] |
Константы скорости определены в системе KNHj / NH. [18]
Константа скорости катализируемой гидроксид-ионом ре - i акции отщепления кислых тиолов от полутиоацеталей [ реак - 1 ция (5.41) в направлении справа налево ] равна 0 8 - 1 0 - Ю10 л / ( моль-с), что характерно для контролируемых диффузией реакций. Константа скорости, оцененная из данных по равновесию, и константы скорости присоединения метилмеркаптоацетата к ацетальдегиду и других каталитических реакций карбонильного присоединения имеют значения, также свидетельствующие о контролируемом диффузией характере процесса стабилизации промежуточного соединения. Слабоосновные амины быстро отщепляются от цвиттер-ионного тетраэдрического промежуточного соединения Т с образованием исходных веществ ( k - iks), поэтому присутствие буфера, катализирующего стабилизацию промежуточного соединения, ускоряет протекание реакции. С другой стороны, отщепление сильноосновных аминов происходит с меньшей скоростью, поэтому процесс распада промежуточного соединения направлен в сторону образования продуктов реакции, а в роли лимитирующей выступает некаталитическая стадия образования промежуточного соединения. [19]
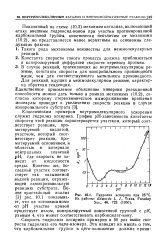 |
Гидролиз аспирина при 25 С. [20] |
Константа скорости такого процесса должна приближаться к контролируемой диффузией скорости переноса протона. [21]
Константы скорости, рассчитанные на основании изменений начального давления, неточны, так как равновесие при 900 К в зависимости от давления лежит в пределах от 20 до 50 % разложения этана и уменьшается при низких температурах. Кроме того, в результате одного опыта почти невозможно точно установить порядок реакции в этой области, так как различие между половинным порядком и первым порядком в течение такого малого интервала времени обычно ниже аналитической точности. [22]
Константы скорости для суммарной реакции довольно хорошо согласуются. [23]
Константа скорости этой реакции k3l 5 107 ехр ( - 26 000 / RT) л / моль-сек. [24]
Константы скорости, вычисленные по данным рисункам, б и в, в пределах ошибок определения равны между собой. Это вполне закономерный факт, так как кривые рисунка, б и е, характеризуют поведение систем одной зоны. [25]
Константа скорости ks реакции протонирования кислорода велика и не появляется в уравнениях скорости. [26]
Константа скорости ( k) химического процесса является очень важной величиной в химической кинетике. Константы скорости реакций различного порядка имеют разную размерность. Следует учитывать, что константы скорости реакций разных порядков являются разными физическими величинами и сопоставление их абсолютных значений лишено смысла. [27]
Константы скорости k и kz даны в такой системе единиц: время в сек. В предэкспоненциальном члене этих уравнений одновременно учтено влияние кислорода на скорость реакции. [28]
Константа скорости - функция [ Н ], ее значение повышается с увеличением концентрации кислоты. Кислотный катализ, возможно, объясняется образованием связи Н с координированной группой CN, что затем облегчает ее перегруппировку с образованием устойчивого изомера с С-связью. Этот эффект близок, видимо, к эффекту, обнаруженному для кислотно-катализируемого обмена цианид-иона с цианидами металлов ( стр. Важно отметить, что изомеризация ( Н20) 5Сг - NC2 не катализируется Сг ( П) и протекает без одновременной аквотации. [29]
Константы скорости формально связаны со свободными энергиями активации Гиббса, и поэтому из их зависимости от температуры и давления можно определить соответствующие энтальпии ( АЯФ), энтропии ( AS), теплоемкости ( АСР) и объемы ( AV) активации. [30]
Страницы: 1 2 3 4