Атом - литий
Cтраница 3
У атома лития в отличие от остальных элементов преднаружный энергетический уровень состоит всего из двух электронов. Такая особенность в строении электронной оболочки его сказывается на некоторых отличительных свойствах лития. [31]
У атома лития магнитный момент должен определяться третьим электроном, поскольку первые два, находящиеся в состоянии Is. [32]
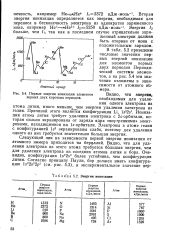 |
Первые энергии ионизации элементов первых двух коротких периодов. [33] |
Ионизация атома лития требует удаления электрона с 25-орбитали, которая сильно экранирована от заряда ядра внутренними электронами, находящимися на ls - орбитали. Электроны в атоме гелия с конфигурацией Is2 экранированы слабо, поэтому для удаления одного из них тр. [34]
У атома лития три электрона, следовательно, два электрона заполнят самую низкую ls - орбиталь, а третий - 25-орбиталь, самую низкую на втором уровне. Следующие электроны у углерода - и азота будут продолжать заполнять пустые р-орбитали. Это соответствует одному из правил квантовой механики: при заполнении однотипных атомных орбиталей ( р, d или. Электроны как носители одноименных зарядов отталкиваются, и электрону легче занять пустую орбиталь, чем войти вторым в уже занятую. [35]
У атома лития, от которого электроны оттягиваются в сторону фтора, возникает некоторый положительный нескомпенсированный заряд. [36]
У атома лития имеются два электрона в первой электронной оболочке и один электрон во второй оболочке. [37]
У атома лития ( заряд ядра 3) в наружном слое один электрон. В случае потери атомом лития одного электрона во всей оболочке атома лития остается два электрона. [38]
Для атома лития ЭО принята равной 1 0; в ряду Be, В, С, N, О, F она постепенно возрастает и у фтора достигает 4 0 - это ее максимальная величина. Фтор - наиболее электроотрицательный элемент, что вполне соответствует свойствам фтора. ЭО водорода равна 2 1, у большинства металлов ЭО 1 7 или меньше. Разность ЭО атомов А и В ( XB - ХА) зависит от степени ионности связи. [39]
В атоме лития ( Z 3) третий электрон попадает в состояние 2s, поскольку в состояниях Is не может находиться одновременно более двух электронов. При заданном Z уровень 2s расположен выше уровня Is; по мере увеличения заряда ядра тот и другой понижаются. Однако при переходе от Z 2 к Z 3 первый эффект значительно преобладает над вторым, и потому энергия связи третьего электрона в атоме Li значительно меньше энергии связи электронов в атоме гелия. Далее, в атомах от Be ( Z 4) до Ne ( Z 10) последовательно добавляются сначала еще один 25-электрон, а затем шесть 2р - электронов. [40]
В атоме лития ( Z 3) третий электрон попадает в состояние 2s, поскольку в состояниях Is не может находиться одновременно более двух электронов. При заданном Z уровень 25 расположен выше уровня 15; по мере увеличения заряда ядра тот и другой понижаются. Однако при переходе от Z 2 к Z 3 первый эффект значительно преобладает над вторым, и потому энергия связи третьего электрона в атоме Li значительно меньше энергии связи электронов в атоме гелия. Далее, в атомах от Be ( Z 4) до Ne ( Z 10) последовательно добавляются сначала еще один 25-электрон, а затем шесть 2р - электронов. [41]
В атоме лития ( Z 3) третий электрон не может занять ls - орбиталь атома, так как иначе он будет иметь волновую функцию, идентичную волновой функции одного из уже присутствую-тих электронов. [42]
В атоме лития начинается построение второго слоя L. У следующих за ним элементов число электронов, последовательно увеличиваясь на единицу, достигает восьми у неона. Восьмиэлектронная ( октетная) конфигурация тоже очень устойчива и обусловливает химическую инертность неона. [43]
В атоме лития валентному электрону предшествует весьма устойчивая двухэлектронная оболочка типа гелия, обладающая большой способностью к поляризации других ионов и молекул и весьма малой поляризуемостью под действием других ионов. [44]
 |
Схемы строения атомов водорода ( 1, гелия ( 2, лития ( 3 и неона ( 4 по Бору.| Схемы строения атомов элементов I-III периодов по Косселю. [45] |
Страницы: 1 2 3 4 5