Атом - азот
Cтраница 2
Атомы азота в степени окисления - 2 ( N2H4) и - 1 ( NH2OH) проявляют восстановительные и окислительные свойства. [16]
Атомы азота в степени окисления - 2 ( N2H4) и - 1 ( NH2OH) проявляют восстановительные и окислительные свойства. [17]
Атом азота в своих соединениях имеет четыре орбиты связей и группирует вокруг себя не более восьми электронов. Поэтому формула классической теории с двумя атомами кислорода, двоесвязанными с азотом, не соответствует действительности. Приведенная ниже формула 1а, предложенная более старой электронной теорией, с одним двоесвязанным атомом кислорода и другим, связанным координационной связью, тоже не изображает удовлетворительным образом реальную молекулу, так как расстояния между атомом азота и обоими атомами кислорода в этой формуле должны были бы быть не равны между собой. С другой стороны, если бы нитрогруппа имела формулу 1а, то дипольный момент и-динитробензола должен был бы отличаться от нуля точно так же, как у гидрохинона или п-фени-лендиамина, тогда как в действительности дипольный момент п-динитробензола равен нулю. [18]
Атомы азота кристаллического фиолетового также являются координационно ненасыщенными. Поэтому ионизированный краситель может реагировать как основание, способное связывать несколько протонов. [19]
Атом азота, введенный при диазотировании из азотистой кислоты, после расщепления входит в состав образовавшейся в азокомпоненте аминогруппы. [20]
 |
Геометрическая изомерия диена.| Геометрическая изомерия триена-1 2 3. [21] |
Атом азота с двойной связью может играть ту же роль в геометрической изомерии, что и двоесвязанный атом углерода. [22]
Атом азота в основном состоянии имеет структуру внешнего электронного слоя 2s22p3 и трехвалентен. [23]
Атом азота в своих соединениях имеет четыре орбиты связей и группирует вокруг себя не более восьми электронов. Поэтому формула классической теории с двумя атомами кислорода, двоесвязанными с азотом, не соответствует действительности. Приведенная ниже формула 1а, предложенная более старой электронной теорией, с одним двоесвязанным атомом кислорода и другим, связанным координационной связью, тоже не изображает удовлетворительным образом реальную молекулу, так как расстояния между атомом азота и обоими атомами кислорода в этой формуле должны были бы быть не равны между собой. С другой стороны, если бы нитрогруппа имела формулу 1а, то дшюлышй момент п-динитробензола должен был бы отличаться от нуля точно так же, как у гидрохинона или п-фени-лендиамина, тогда как в действительности дипольный момент п-динитробепзола равен нулю. [24]
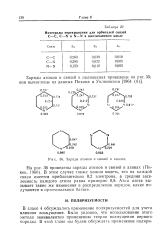 |
Заряды атомов и связей в азинах. [25] |
Атом азота вызывает такие же изменения в распределении зарядов, какие получаются в ортогональном базисе. [26]
Атом азота в изолированном состоянии имеет - конфигурацию валентных электронов. При образовании соединений с атомами других элементов в зависимости от электронного строения последних - конфигурация может или достраиваться до стабильной - конфигурации за счет приема электронов от партнеров по соединениям или перестраиваться за счет s - p - ne - реходов, например, в / - конфигурацию, один из электронов которой легко может быть передан партнеру - акцептору, в результате чего в конечном счете атом азота приобретает / - конфигурацию. Эти случаи являются предельными и достигаются в чистом виде, вероятно, не в очень большом числе соединений азота; в большинстве случаев следует ожидать образования обеих устойчивых конфигураций с различным статистическим весом. [27]
Атом азота в основном состоянии имеет структуру внешнего электронного слоя 2s22p3 и трехвалентен. Вопрос о возбуждении его иных валентных состояний был рассмотрен ранее ( VI § 3 доп. Сродство атома азота к одному электрону оценивается в 12 ккал / г-атом, к трем в - 500 ккал / г-атом. [28]
Атомы азота не образуют устойчивых цепей и циклов, как предполагают, из-за отталкивания неспаренных электронов. [29]
Атом азота не может иметь пять одиночных электронов. Для этого потребовалось бы перевести один из них на следующий - третий энергетический уровень, что связано с большими затратами энергии, которые не смогут быть компенсированы энергией, выделяющейся при образовании связей. [30]
Страницы: 1 2 3 4