Кривая - гидрирование
Cтраница 1
Кривая гидрирования этой смеси состоит из трех участков с двумя перегибами. [1]
Кривая гидрирования карбинола в воде имеет сложный ход: до поглощения 90 мл водорода из газовой фазы гидрирование протекает в среднем со скоростью 9 2 мл / мин, а затем скорость возрастает до 28 мл / мин и проходит через максимум. Как показал хроматографический анализ, на первом участке гидрируется в основном тройная связь. [2]
При снятии кривой гидрирования одновременно с пуском качалки включают секундомер и через определенные промежутки времени замеряют объем израсходованного водорода по газовой бюретке. Замеры производят в начале опыта Через каждые 30 с, а при уменьшении скорости реакции через большие промежутки времени. Продолжительность опыта зависит от навески и природы гидрируемого соединения, количества и активности катализатора, условий опыта. [3]
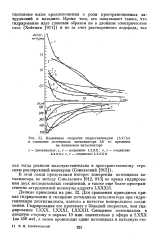 |
Изменение скорости гидрогенизации ( AF / Д. [4] |
Для сравнения приводится кривая гидрирования и смещение потенциала катализатора при гидрогенизации диэтилмалеата, взятого в качестве контрольного соединения. Гидрирование его протекает с большей скоростью, чем гидрирование LXXX. Смещение потенциалов в анодную сторону в первые 10 мин. [5]
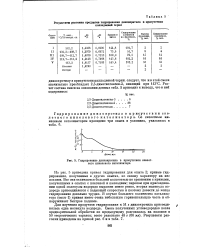 |
Гидрирование диизокротила в присутствии скелетного никелевого катализатора. [6] |
На рис. 5 приведена кривая гидрирования для опыта 2; кривые гидрирования, полученные в других опытах, по своему характеру на нее похожи. Все они отличаются большей пологостью по сравнению с кривыми, полученными в опытах с платиной и палладием; перелом при присоединении одной молекулы водорода выражен менее резко, вторая молекула водорода присоединяется с падающей скоростью и поэтому довести до конца гидрирование довольно трудно. В случае большего количества катализатора ( опыт 1) кривая имеет очень небольшую горизонтальную часть и обнаруживает быстрое падение. [7]
На рис. 5 представлена кривая гидрирования диметилацетиленилкар - Сншола. [8]
Благодаря резкому перелому на кривой гидрирования при переходе от тройной к двойной связи можно рассчитать раздельно энергию активации гидрирования этих связей. Интересно отметить, что энергии активации гидрирования двойной и тройной связи имеют различный температурный ход, что связано с тем, что оптимальные межатомные расстояния для гидрирования тройной связи ближе к соответствующим расстояниям для активации водорода, чем для активации двойной связи. [9]
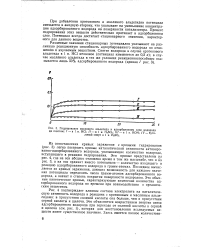 |
Гидрирование масляного альдегида в адсорбционном слое водорода на платине. / - в 1 н, НС1. / / - в 1 н. H2S04. / / / - в 1 н. КОН. IV - бути. [10] |
Из сопоставления кривых заряжения с кривыми гидрирования ( рис. 3) легко построить кривые каталитической активности активиро-ванно-адсорбированного водорода, указывающие количество водорода, вступающего в реакцию гидрирования. Эти кривые представлены а рис. 4, где на оси абсцисс отложено время в том же масштабе, что и на рис. 3, а на оси ординат вместо потенциала - количество входящего в реакцию адсорбированного водорода в грамм-атомах. Последнее вычисляется из кривых заряжения, дающих возможность для каждого значения потенциала определить число грамм-атомов адсорбированного водорода, а значит и степень покрытия поверхности водородом. [11]
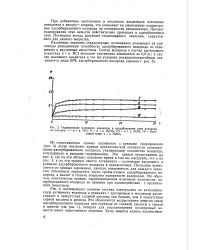 |
Гидрирование масляного альдегида в адсорбционном слое водорода на платине. I - ъ 1 н. НС1. / / - в 1 н. H2SO4. III - в 1 н. КОН. IV - бутиловый спирт в 1 н. [12] |
Из сопоставления кривых заряжения с кривыми гидрирования ( рис. 3) легко построить кривые каталитической активности активиро-ванно-адсорбированного водорода, указывающие количество водорода, вступающего в реакцию гидрирования. Эти кривые представлены н а рис. 4, где на оси абсцисс отложено время в том же масштабе, что и на рис. 3, а на оси ординат вместо потенциала - количество входящего в реакцию адсорбированного водорода в грамм-атомах. Последнее вычисляется из кривых заряжения, дающих возможность для каждого значения потенциала определить число грамм-атомов адсорбированного водорода, а значит и степень покрытия поверхности водородом. [13]
Изменение количества катализатора не влияет на характер кривой гидрирования. [14]
Обе двойные связи должны гидрироваться одновременно, а кривая гидрирования по форме должна напоминать кривую гидрирования смеси однородных по степени замещения моноэтиленовых веществ. Если прервать процесс гидрирования после присоединения одной молекулы водорода, то продукты гидрирования должны представлять собой смесь исходного диена, моноолефинов ( продуктов присоединения водорода в положении 1 2 и 3 4) и вполне насыщенного вещества. Среди продуктов неполного гидрирования должны отсутствовать продукты присоединения водорода в места 1 и 4 сопряженного диена. Примером вещества этого типа можно считать дипропенил; действительно, кривая гидрирования дипропенила в присутствии платиновой черни имеет, по Лебедеву, перелом в точке, где присоединилось 70 % водорода, однако подробного анализа продуктов реакции, на основании которого можно было бы с полной уверенностью отнести дипропенил к типу II или типу IVB, Лебедев не приводит. Таким образом, как уже было сказано выше, все исследованные Лебедевым вещества должны быть отнесены к типу II предложенной им классификации диенов, так как присоединение водорода к ним в присутствии платины происходит во всех возможных направлениях. [15]
Страницы: 1 2 3