Молекула - пиррол
Cтраница 2
Частота валентных колебаний NH в неассоциированной молекуле пиррола составляет 3496 см-1 ( в СС14), и интенсивность полосы выше, чем для насыщенных вторичных аминов. Существует четкая корреляция между кислотностью связи N - Н и частотой соответствующих валентных колебаний, причем показано, что эффекты заместителей в а - и р-положениях приблизительно аддитивны. Существуют также доказательства межмолекулярной водородной связи между NH и карбонильной группой. [16]
Частота валентных колебаний NH в неассоциированной молекуле пиррола составляет 3496 см 1 ( в ССЦ), и интенсивность полосы выше, чем для насыщенных вторичных аминов. Существует четкая корреляция между кислотностью связи N - Н и частотой соответствующих валентных колебаний, причем показано, что эффекты заместителей в ее - и р-положениях приблизительно аддитивны. При наличии а-карбонильной или а-алкоксикарбонильной группы образуется внутримолекулярная водородная связь [15, 16] с группой NH [ структуры ( 8а) и ( 86) ], причем частота колебаний NH может уменьшаться на 45 см-1. Существуют также доказательства межмолекулярной водородной связи между NH и карбонильной группой. [17]
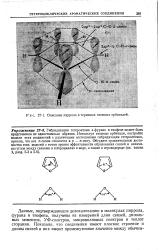 |
Описание пиррола в терминах атомных орбиталей. [18] |
Данные, подтверждающие делокализацию в молекулах пиррола, фурана и тиофена, получены из измерений длин связей, диполь-ных моментов, УФ-спектров, микроволновых спектров И теплот сгорания. [19]
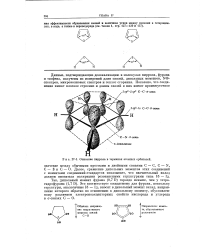 |
Описание пиррола в терминах атомных орбиталей. [20] |
Данные, подтверждающие делокализацию в молекулах пиррола, фурана и тиофена, получены из измерений длин связей, дипольных моментов, УФ-спектров, микроволновых спектров и теплот сгорания. [21]
Приведенные в табл. 3.1 данные показывают, что молекула пиррола имеет значительно более высоколежащие фронтальные орбитали TIO сравнению с пиридином. Азолы ( имидазол, пиразол), как и следовало ожидать, занимают промежуточное положение. С увеличением протяженности я-системы соединение становится более я-донорным и одновременно более я-акцептор-ным, например: акридин хинолин пиридин или индолпиррол. Существует тенденция к увеличению я-донорности по мере уменьшения ароматичности. [22]
Соли пиррола используются для введения алкила или ацила в молекулу пиррола. [23]
В каком валентном состоянии находятся гете-роатомы и атомы углерода в молекулах пиррола, фура-на и тиофена. [24]
В каком валентном состоянии находятся ге-тероатомы и атомы углерода в молекулах пиррола, фу-рана и тиофена. [25]
Постройте схему, поясняющую эту реакцию, имея в виду наличие в молекуле пиррола сопряженной системы, реагирующей согласно теории парциальных валентностей. [26]
Порфирины представляют собой производные порфина ( I), который построен из четырех молекул пиррола, соединенных в циклическую структуру четырьмя метановыми мостиками. Наибольшее распространение в природе получил порфирин, в котором заместителями в кольце порфина служат четыре метальные, две винильные и две карбоксильные группы. [27]
Ацетил ндикарбопован кислота или ее эфиры могут также реагировать таким пбразсш, что дпс молекулы пиррола вступают шп взаимодействие только с одной мо - лккулой ненасыщенной кислоты. [28]
Так как сопряженная электронная система в молекуле пиридина значительно более устойчива, чем в молекуле пиррола, пиридин гидрируется труднее, чем пиррол. [29]
В нашем случае это структура I, и она действительно наиболее близка к реальной структуре молекул пиррола, хотя можно предположить, что в какой-то степени будут проявляться также свойства резонансных структур II-V. Если структуру соединения можно описать с помощью нескольких энергетически неэквивалентных резонансных структур, то обычно изображается та из них, которая имеет наименьшую энергию. [30]
Страницы: 1 2 3 4