Теоретическое напряжение - разложение
Cтраница 2
При повышении температуры от 20 до 80 С теоретическое напряжение разложения уменьшается от 1 23 до 1 18 В. Большее значение имеет снижение перенапряжения на катоде и аноде с ростом температуры. Так, при изменении температуры от 18 до 80 С ( см. табл. 2 - 1) оно суммарно может достигать нескольких сот милливольт. Сопротивление электролита с ростом температуры также снижается, что благоприятно сказывается на напряжении на ячейке. [16]
Практически напряжение берут не 2 166 в ( теоретическое напряжение разложения NaCl), а несколько больше ( 3 - 4 в), так как в ванне имеют место потери напряжения. Следовательно, электроэнергии расходуется практически больше, чем это нужно теоретически. Поэтому, помимо выхода по току, различают еще коэффициент использования энергии. [17]
Я - общее напряжение на ячейке; Е0 - теоретическое напряжение разложения; шх - химическая энергия продуцируемых газов. [18]
В практических условиях напряжение разложения воды вследствие поляризации всегда значительно выше теоретического напряжения разложения и составляет около 1 7-в при платиновых платинированных электродах. [19]
Теоретический расход энергии ( обозначенный через ТР) при получении 67 94 кг хлора равен произведению теоретического напряжения разложения ( 2 19 в) на количество затраченных ампер-часов. Это количество также можно определить как частное от деления количества вещества, полученного при электролизе, на химический эквивалент. [20]
Каковы значения теоретического расхода электроэнергии на 1 т едкого натра и на 1 т хлора при диа-фрагменном способе электролиза хлорида натрия, если теоретическое напряжение разложения Е водного раствора NaCl равно 2 18 В. [21]
Из этих данных следует, что при замене катодного процесса разряда ионов водорода процессом восстановления ионов Си2 до Си или восстановления иона Hg2 до металлической ртути теоретическое напряжение разложения понижается. Однако величины термодинамически обратимых электродных потенциалов и теоретического напряжения разложения не определяют однозначно величину напряжения на ячейке. Она зависит также от перенапряжения для анодного и катодного процесса, от состава, концентрации, электропроводности и температуры электролита, а также от конструкции электролизера. Нормальный потенциал разряда ионов никеля более электроотрицателен, чем ионов водорода, однако из-за влияния перечисленных факторов, прежде всего высокого перенапряжения выделения водорода, процесс электролиза хлористого никеля можно проводить при более низком напряжении на ячейке, чем прямой электролиз соляной кислоты. [22]
Из приведенных данных следует, что при замене на катоде процессов разрядки ионов водорода процессами восстановления ионов двухвалентной меди до одновалентной или двухвалентной ртути до металлической снижается значение теоретического напряжения разложения. [23]
 |
Потенциал никелевого электрода при катодной и анодной поляризации. [24] |
При этом значительно снижается напряжение на ячейке за счет уменьшения перенапряжения на аноде и катоде, потерь напряжения на преодоление электрического сопротивления электролита и диафрагмы и некоторого уменьшения теоретического напряжения разложения. [25]
При вполне обратимом процессе электролиза со степенью использования тока 100 % мерой электрической энергии, теоретически необходимой для проведения процессов, является произведение количества электричества, необходимого для выделения определенного количества вещества, на теоретическое напряжение разложения. [26]
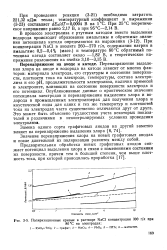 |
Поляризационные кривые в растворе NaCl концентрации 300 г / л при. [27] |
При концентрации NaCl в анолите 260 - 270 г / л, содержании натрия в амальгаме 0 2 - 0 4 % ( масс.) и температуре 80 С обратимый потенциал катода составляет около - - 1 82 В, а теоретическое напряжение разложения на ячейке 3 10 - 3 15 В. [28]
Кислород разряжается на аноде, соединяясь с углеродом электрода; для протекания этой реакции требуется 12 фарадей электричества. Теоретическое напряжение разложения для этой реакции составляет около 1 2 В, поскольку большая часть энергии, необходимой для разложения окиси алюминия, заимствуется из той энергии, которая выделяется при окислении углерода. [29]
Как известно, напряжение при электролизе складывается из равновесных электродных потенциалов, составляющих в сумме теоретическую величину напряжения разложения, из перенапряжений на электродах, омических потерь между электродами в электролите и в проводниках первого рода, подводящих ток к межэлектродному пространству. Теоретическое напряжение разложения, в свою очередь, зависит от давления, температуры, концентрации рассола и содержания натрия в амальгаме. [30]
Страницы: 1 2 3 4