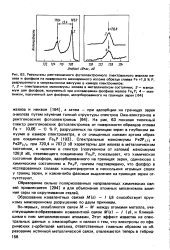
Образование - ковалентная связь
Cтраница 2
Образование ковалентной связи за счет локализованной пары электронов было постулировано еще в 1916 г. Льюисом, который разработал электронную теорию гомеополярной связи. [16]
Образование ковалентных связей M ( s) - I ( / э) способствует хрупкому межзеренному разрушению по двум причинам. [18]
Вследствие образования ковалентной связи с волокном красители этого типа обладают превосходной прочностью к стирке и трению. [19]
Вследствие образования ковалентной связи с волокном красители этого типа обладают превосходной прочностью к стирке и трению. [20]
Установлено образование ковалентной связи между молекулами ПЭТФ и красителя. [21]
Рассмотрим образование ковалентной связи на примере некоторых молекул. [22]
Как образование ковалентной связи описывается квантово-механической теорией строения атома. Почему перекрывание электронных облаков приводит к образованию химической связи. Что удерживает ядра на расстоянии длины связи. [23]
Для образования ковалентной связи с протоном основания Бренстеда должны предоставлять либо неподеленную пару электронов, либо электроны я-связи. В соответствии с этим основания Бренстеда делятся на п-основания и л-основания. [24]
Для образования ковалентной связи между двумя атомами их валентные орбитали должны частично пространственно перекрываться. [25]
Изображают образование ковалентных связей по-разному. [26]
Кроме образования ковалентной связи путем обобщения двумя атомными ядрами пары электронов, сформированной из неспаренных электронов свободных атомов, возможен иной путь образования такой связи - за счет обобществления двумя ядрами пары электронов, принадлежащей одному из атомов. Эти электроны должны иметь одинаковые значения це - лочисленных квантовых чисел и противоположные по знаку спиновые числа. Иногда эту ковалентную связь не совсем правильно называют донорно-акцепторной связью. [27]
 |
Радиусы ( атомный и ионный и первые энергии ионизации щелочных и щелочноземельных металлов. [28] |
Однако образование ковалентных связей не характерно для щелочных металлов. В табл. 10.3 приведены энергии ионизации и атомные радиусы для щелочных металлов и щелочноземельных элементов. Значения энергий меньше, чем для других элементов; это указывает на то, что внешние s - электроны могут быть относительно легко удалены. [29]
Для образования одинарной ковалентной связи необходимо, чтобы атом имел орбиту, занятую одним неспаренным электроном; для установления четырех связей атом углерода в решетке алмаза должен иметь четыре неспаренных электрона. Однако конфигурация электронного облака изолированного атома углерода в его нормальном состоянии имеет лишь два неспаренных электрона: Is22s22p2, при этой конфигурации могут установиться только две ковалентные связи. Следовательно, в общем случае направленные ковалентные связи могут обладать различной конфигурацией, которая характеризуется прямым или комбинированным спариванием s, p и / электронов. [30]
Страницы: 1 2 3 4