Контактная ионная пара
Cтраница 2
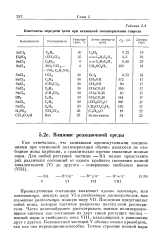 |
Константы передачи-цепи при катионной полимеризации стирола. [16] |
Промежуточные состояния включают прочно связанную, или контактную, ионную пару VI и разделенную растворителем, или солъватно разделенную, ионную пару VII. Последняя представляет собой ионы, которые частично разделены молекулами растворителя. Часто целесообразнее рассматривать ионные полимеризую-щиеся системы как состоящие из двух типов растущих частиц - ионной пары и свободного иона VIII, находящихся в равновесии друг с другом. Ковалентной частицей V обычно можно пренебречь, так как она нереакционноспособна. [17]
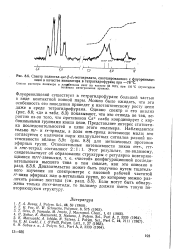 |
Спектр полиэтил-ч с - 3 - г / 1-метакрилата, синтезированного с флуоренияце-зием в качестве инициатора в тетрагидрофуране при - 78 С. [18] |
Флуоренилцезий существует в тетрагидрофуране большей частью в виде контактной ионной пары. [19]
При комнатной температуре в 2-метил - ТГФ наблюдается спектр контактной ионной пары, тогда как в ТГФ при 25 С спектр отражает наличие только разделенных ионных пар. Эквимолярная смесь трифениленнатрия и тетраглима ( 10 - 2 М) в 2-метил - ТГФ имеет спектр, аналогичный наблюдаемому в ТГФ; это означает, что образуются разделенные глимом ионные пары. [20]
Частицу ( 2) называют внутренней ионной парой ( контактной ионной парой), она имеет сольватную оболочку. Частица ( 3) - внешняя ионная пара ( сольватно-разделенная ионная пара), также с сольватной оболочкой, однако некоторые молекулы растворителя находятся между ионами. [21]
Вследствие большей поляризации разделенных ионных пар по сравнению с контактными ионными парами, вероятно, возрастает степень полярности промежуточного переходного комплекса циклосилоксана с активным центром в присутствии промотора, что приводит к увеличению реакционной константы. [22]
Наибольшей реакционной способностью в этом случае обладает, вероятно, контактная ионная пара, что может быть связано с участием катиона в стабилизации активированного комплекса. С другой стороны, окисление калиевой соли тритил-аниона ускоряется [83, 84] при переходе к полярным растворителям и в присутствии добавок циклогексил-18 - крауна-6, т.е. с увеличением доли свободных анионов, а в реакции кислорода с натриевыми солями 9-замещенных флуоренов [85] отношение & и / & и. В последнем случае немаловажную кинетическую роль играет образование промежуточного комплекса между окислителем и окисляемым соединением. [23]
При использовании подходящих модельных систем метод ПМР-спектроскопии также пригоден для изучения превращений контактной ионной пары в ионную пару, разделенную молекулами растворителя. [24]
Региоселек-тивность в последнем случае объясняется тем, что нуклеофил вступает в реакцию в виде контактной ионной пары, в которой катион калия координирован с нитрогруппой. [25]
В этом же направлении работает и уменьшение сольватирующей способности р-рителя, сдвигая равновесие между сольватно-разделенными и контактными ионными парами в сторону последних. Аналогично, добавление к р-ру р-рителя с низкой донорной способностью увеличивает число ионных ассоциатов, в результате чего уменьшается электропроводность р-ра. В противоположном направлении действует добавление р-рителя с большой донорной способностью. [26]
В малополярном органическом растворителе ( СЕ СЦ CHC13, СеНб, СбН5СН3 и др.) образуется контактная ионная пара R4N Nu, обладающая очень высокой реакционной способностью. Высокая нуклеофильность аниона Nu в малополярных органических растворителях обусловлена, во-первых, тем, что он практически не сольватирован в этой среде и, во-вторых, большим межнонным расстоянием ( порядка 4 - 5 А) между катионом R4N и анионом Nu в контактной ионной паре этих ионов, т.е. недостаточно сильной электростатической стабилизацией аниона в ионной паре. [27]
Сильный нуклеофил N3 оказывается ловушкой для сольватно-разделенных ионных пар, подавляя стадию возврата k нз сольватно-разделеииой в контактную ионную пару. ЖЕ отражает не весь возврат ионных пар, а является только его нижним пределом, поскольку часть возврата происходит без перемещения изотопной метки. [28]
Сольватация ( или образование комплексов с различными добавками) может приводить либо к дисперсии заряда катиона в контактной ионной паре, либо к образованию нового вида ионной пары - разделенной растворителем, или рыхлой, ионной пары. В последнем случае катион фактически окружен молекулами растворителя и заметно отделен от аниона. Поэтому его спектр напоминает спектр свободного аниона. [29]
Предполагается, что растворитель сольватирует соль карбаниона и щелочного металла таким образом, что в ходе сольватации образуются сначала контактная ионная пара, затем сольватно разделенная и, наконец, свободные карбанион и катион. [30]
Страницы: 1 2 3 4