Процесс - восстановление - кислород
Cтраница 3
Несовершенная изоляция рельсов / от земли приводит к утечке тока в окружающий грунт. В этих зонах идет процесс восстановления кислорода, что приводит к уменьшению их коррозионного разрушения, вызываемого контактом с грунтом. В анодных зонах ( А), где ток стекает с газопровода, происходит дополнительное разрушение металла, пропорциональное этому току. Следовательно, в анодных зонах разрушения металла от почвенной коррозии и блуждающих токов накладываются друг на друга. Разрушения при коррозии, вызываемой блуждающими токами, концентрируются обычно на большой поверхности металла, носят ярко выраженный язвенный характер и имеют круглую или продолговатую форму с крутыми стенками. Следует отметить, что даже при активном развитии электрокоррозии, вызываемой переменным током, потери от нее не превышают нескольких процентов от соответствующих потерь в стабильных анодных зонах от постоянного тока. Однако при этом форсируется развитие местных повреждений, создающих опасность образования сквозных отверстий в стенках газопровода. [31]
 |
Снижение напряжения при электросинтезе перманганата. [32] |
Предложен способ интенсификации катодного восстановления кислорода при проведении процессов электролиза с деполяризацией путем введения в католит ( разбавленная щелочь) добавок трифторметиленсульфоновой кислоты ( пат. Установлено, что скорость процесса восстановления кислорода на катоде в присутствии трифторметиленсульфоновой кислоты возрастает примерно в 2 раза. Высказывается предположение, что данный эффект может быть использован в производстве хлора и гидроксида натрия в электролизере с ка-тионообменной мембраной и анодами на основе диоксида рутения. Оптимальная концентрация трифторметиленсульфоновой кислоты составляет 1 моль / л 4 М щелочи. [33]
В выражении ( П-55) допускается некоторая неточность в связи с тем, что на разложение воды используется не 100 % тока. Часть тока, затраченная на утечку по каналам, на процессы восстановления кислорода и окисления водорода, не расходуется на разложение воды и потому целиком превращается в тепло. [34]
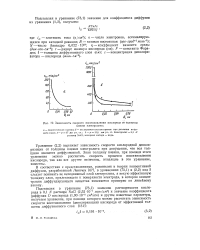 |
Зависимость скорости восстановления кислорода от толщины пленки электролита. [35] |
Уравнение ( 2 2) выражает зависимость скорости кислородной деполяризации от толщины пленки электролита при допущении, что вся толщина является диффузионной. Зная толщину пленки, при помощи этого уравнения можно рассчитать скорость процесса восстановления кислорода, так как все другие величины, входящие в это уравнение, известны. [36]
Для снятия катодных поляризационных кривых использовали раствор 0 5 % - иого КС1, не содержащий цианида, но насыщенный кислородом при заданном парциальном давлении. Видно, что при значительном смещении потенциала золотого электрода в отрицательную сторону процесс восстановления кислорода смещается из области электрохимической кинетики в область диффузионной кинетики, где скорость катодной реакции контролируется скоростью диффузии молекул растворенного кислорода к поверхности электрода. [37]
В выражениях ( 2 - 36) и ( 2 - 36а) допускается некоторая неточность, обусловленная тем, что на разложение воды расходуется не 100 % тока. Часть тока, составляющая утечки по каналам, а также используемая в процессах восстановления кислорода и окисления водорода, не участвует в процессе разложения воды, и поэтому целиком превращается в тепло. Однако эта часть тока не велика. [38]
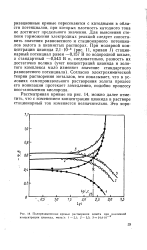 |
Поляризационные кривые растворения золота при различной концентрации цианида, моль / л. 1 - 2 1. 2 - 5 5. 3 - 14 4 - 10. [39] |
Для выяснения степени торможения электродных реакций следует сопоставить значения равновесного и стационарного потенциалов золота в цианистых растворах. Согласно электрохимической теории растворения металлов, это показывает, что в условиях самопроизвольного растворения золота процесс его ионизации протекает замедленно, подобно процессу восстановления кислорода. [40]
 |
Поверхность серебряного диска после, растворения ( а и схема движения жидкости у поверхности вращающегося диска ( б. [41] |
Все это обусловило различие теоретических концепций и взглядов на процесс растворения серебра и золота в цианистых растворах. Одни авторы считали, что фактором, лимитирующим скорость процесса растворения, является скорость химической реакции, протекающей на поверхности растворяющегося металла, тогда как другие наиболее медленным этапом считали скорость диффузии реагентов ( цианида и кислорода) к этой поверхности, третьи же исходили из теории локальных короткозамкнутых элементов, обращая особое внимание на процесс восстановления кислорода. [42]
Обычная кривая, характерная для процесса восстановления кислорода ( область ионизации кислорода, концентрационной поляризации и перенапряжения водорода), наблюдается лишь в электролите, не содержащем бихромата. В присутствии же бихромата калия все кривые уже при небольших плотностях тока круто поднимаются вверх, что указывает на сильную катодную поляризацию. [43]
Путем сравнения электродных потенциалов данной окислительно-восстановительной пары с потенциалом водородного и кислородного электродов устанавливают характер ее поведения в воде. Например, если сравниваемый потенциал больше потенциала кислородного электрода, данная окислительно-восстановительная пара способна разложить воду с выделением кислорода. Если потенциал пары меньше потенциала кислородного электрода, возможен процесс восстановления кислорода, растворенного в воде до ионов гидроксила. [44]
Отсюда следует, что можно синтезировать высокоэффективные металлсодержащие электроноионообменники, обладающие высокой скоростью восстановления растворенного в воде кислорода. Этого можно добиться путем создания электрохимически гетерогенной системы. Во-первых, подбором для синтеза элек-троноионообменников ионитов с каркасами, обладающими электронной проводимостью, во-вторых, нанесением на иониты совместно с металлом-восстановителем подходящего второго металла с более электроположительным потенциалом, выступающего в процессе восстановления кислорода в качестве микрокатода. [45]
Страницы: 1 2 3 4