Процесс - восстановление - кислород
Cтраница 4
Создание элементов воздушной деполяризации, а в последние годы - водородно-кислородных топливных элементов, повысило интерес к механизму работы электродов, на которых происходит процесс ионизации молекулярного кислорода. Бур-штейн показали, что на угольных электродах кислород адсорбируется как в молекулярном, так и в атомарном виде. В процессе восстановления молекулярно адсорбированного кислорода первично образуется перекись водорода, которая в дальнейшем может разлагаться каталитически или восстанавливаться электрохимически в воду. В процессе восстановления кислорода, адсорбированного в атомарном виде, образуется вода без промежуточного образования перекиси водорода. [46]
В последнее время вращающийся дисковый электрод был усовершенствован нанесением на рабочую поверхность дополнительного изолированного кольца. Дисковый электрод с кольцом позволяет не только исследовать основной электрохимический процесс, но и образующиеся полупродукты реакции. Например, в процессе восстановления кислорода, наряду с полезной ( в смысле использования энергии, выделяющейся при окислении водорода в топливном элементе) реакцией образования воды, происходит и вредная реакция - образование перекиси водорода. [47]
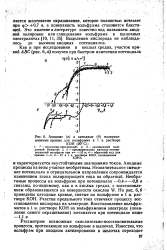 |
Анодные ( а и катодные ( б поляризационные кривые для вольфрама в I и. растворе. [48] |
Анодные процессы на этом участке необратимы. Незначительное смещение потенциала в отрицательном направлении сопровождается изменением знака поляризующего тока на обратный. Необратимые процессы на вольфраме при потенциалах - 0 4н - 0 8 в связаны, по-видимому, как и в кислых средах, с восстановлением образовавшихся на поверхности окислов W. Участки предельного тока отвечают процессу восстановления кислорода на электроде. [49]
За последние годы в нашей лаборатории удалось разработать методы, позволяющие изучить электрохимическую кинетику применительно к коррозионным процессам, протекающим в атмосфере. На рис. 1 представлены катодные поляризационные кривые, характеризующие зависимость скорости восстановления кислорода на меди и железе от толщины слоя электролита. В условиях, когда процесс определяется диффузией, наблюдается исключительно закономерное изменение скорости катодного процесса и предельного диффузионного тока по кислороду с толщиной пленки электролита. При наличии на металле тонких слоев (: 70 мк) процесс восстановления кислорода протекает настолько быстро, что при выбранных нами плотностях тока электрод поляризуется слабо. [50]
Как уже отмечалось, самый простой, доступный и весьма эффективный ингибитор для защиты стали в воде - нитрит натрия. Механизм его действия состоит в торможении анодного процесса, а эффективная защита может быть достигнута только тогда, когда анодный процесс подавлен полностью. Замедление анодного процесса происходит за счет пассивации железа оксидной пленкой Fe2O3, образовавшейся на поверхности стали при окислении нитритом. При малых концентрациях нитрита натрия в водном растворе большая часть поверхности экранируется и скорость анодного процесса на открытых участках увеличивается, так как облегчается процесс восстановления кислорода. [51]
Эффективная толщина диффузионного слоя вследствие саморазмешивания является величиной переменной. При наличии в тонких слоях конвекционного переноса кислорода любые факторы, усиливающие размешивание верхних слоев, должны приводить к уменьшению эффективной толщины диффузионного слоя и увеличению скорости восстановления кислорода. На рис. 3 представлены кривые зависимости потенциала медного катода в пленке 0 1 N NaCl ( исходная толщина 160 мк) при различных относительных влажностях воздуха над раствором от количества пропущенного электричества. Для сравнения приводится кривая, снятая в объеме электролита. Представленные кривые указывают на то, что процесс восстановления кислорода на медном катоде в тонких пленках электролита с уменьшением относительной влажности воздуха над электродом сильно облегчается. [52]
Детальные исследования, проведенные в основном в лаборатории проф. Мальмстрема, показали, что ионы меди не эквивалентны и существенно различаются в структурно-функциональном отношении. Это заставляет думать о более детализированной картине процессов, происходящих в активном центре фермента. При обсуждении механизмов реакций иногда полезно обратиться к термодинамическим данным, характеризующим образование возможных промежуточных соединений. В табл. 23 приведены окислительно-восстановительные потенциалы различных промежуточных соединений, возможно возникающих в процессе восстановления кислорода до воды. [53]
Определение микроколичеств кислорода в малых объемах газов [887] осуществляют в двухкамерной ячейке с серебряным катодом и платиновым анодом. В качестве фона при определении кислорода в инертных газах, газообразных предельных и непредельных углеводородах используют 25 % раствор КОН. При определении О2 в углекислом газе или газовых смесях с высоким содержанием СО2 применяют кадмиевый или железный анод. Кулонометрическая ячейка снабжена газовой бюреткой для отбора проб и вспомогательным сосудом, в котором находятся газ или газовая смесь для промывания ячейки. Определение проводят, вводя в ячейку известный объем анализируемого газа и интегрируя количество электричества, протекшее через ячейку в ходе процесса восстановления кислорода. Интегрирование осуществляют графически или с помощью электронного интегратора. Для определения 1 - 100 частей Оа на 1 млн. частей анализируемого газа необходимо - 2 мл пробы, а при определении 0 1 - 100 % О2 - всего лишь сотые доли миллилитра. Ошибка этого способа определения - 10 - 9 г О2 составляет примерно 5 отн. [54]
Страницы: 1 2 3 4