Реакция - образование - перекись
Cтраница 2
Нам казалось, что повышение эффективности - [ - излучения по отношению к реакции образования перекиси водорода может быть достигнуто иными путями. Одним из них может явиться использование подходящей химической реакции, позволяющей осуществить разделение продуктов радиолиза воды посредством увода из зоны реакции окислительного или восстановительного компонента. [16]
Схема горения углеводородов может быть представлена как последовательное чередование реакций зарождения цепей - ( образование радикалов R), продолжения цепей с реакциями образования перекисей ROO и гидроперекисей ROOH, разветвления цепей при разложении гидроперекисей на окись RO и гидроксил ( ОН), и реакций параллельных, в которых образуются вода, окиси и перекиси. [17]
Таким образом, в полном соответствии с фотоэлектрохимическими исследованиями принимается, что именно процессы, приводящие к электронному возбуждению полупроводника ( ZnO), ответственны за протекание реакции образования перекиси водорода на окиси цинка в окислительно-восстановительной среде при действии ионизирующего излучения. Невидимому, механизм протекания реакции принципиально не отличается от того, который был предложен для фотоэлектрохимического процесса. Адсорбированный на окиси цинка акцептор электронов ( 02, Н20) воспринимает энергию электронного возбуждения полупроводника ( ZnO) и в дальнейшем взаимодействует с отдельными компонентами окислительно-восстановительной среды. [18]
Найдено, что водяной пар и особенно аргон являются энергетическими катализаторами электросинтеза перекиси водорода, которые при определенных условиях ( в зависимости от концентрации добавок, температуры реактора, величины Ulv) ускоряют в основном одну реакцию образования перекиси водорода. [19]
Чтобы иметь уверенность в том, что перманганата хватило на окисление всех могущих присутствовать в растворе восстановителей, и в том числе на окисление ионов Сг1, его нужно прибавлять до тех пор, пока раствор над осадком не будет ( по окончании нагревания) окрашен в малиново-фиолетовый цвет, свидетельствующий об избытке КМпСХ Добившись этого, осадок МпО ( ОН) 2 отфильтровывают, а раствор испытывают ( по охлаждении) на присутствие Сг2ОГ - реакцией образования перекиси хрома ( см. ниже, стр. [20]
При изучении влияния температуры показано, что в пределах от - 35 до 8 выход перекиси водорода ( по кислороду) и ее концентрация практически не изменяются. Вычислена энергия активации реакции образования перекиси водорода в барьерном разряде, оказавшаяся равной 1200 кал / моль. [21]
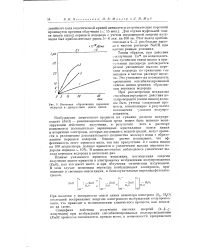 |
Кинетика образования перекиси водорода в [ присутствии окиси цинка. [22] |
Таким образом, при действии - - излучения Со60 на воднощелоч-пые суспензии окиси цинка в присутствии кислорода наблюдается резкое увеличение выхода перекиси водорода по сравнению с ее выходом в чистом растворе щелочи. Это указывает на возможность протекания сенсибилизированной окисью цинка реакции образования перекиси водорода. [23]
С понижением / о2 растет время жизни стирольных радикалов и поэтому увеличивается скорость перегруппировки и деполимеризации радикала с образованием неперекисных продуктов. Эти реакции с уменьшением / о2 все сильнее вытесняют реакцию образования перекиси, но общая скорость реакции меняется незначительно до рог 10 мм рт. ст. Окись стирола и бензальдегид образуюгся ценным путем. С увеличением ро2 растет относительное содержание таких радикалов, и максимум выхода альдегидов достигается при больших рог. [24]
Число существующих литературных данных по получению перекиси водорода в тихом электрическом разряде очень мало и большинство из них сосредоточено в патентах. Кроме того, в литературе неизвестно какого-либо полного исследования влияния различных параметров на реакцию образования перекиси водорода из элементов в тихом разряде. Вследствие этого было интересно провести изучение влияния физико-химических параметров на процесс электросинтеза перекиси водорода из элементов с целью выяснения оптимальных условий для получения чистой концентрированной перекиси водорода. Исследование проведено нами в озонаторах разного типа и масштаба: стеклянных и стеклянно-метал-лических, лабораторных и укрупненных. [25]
В 1926 г. Маршалл ( 68), проводя опыты в условиях быстрой струи, показал, что если при комнатной температуре смесь водорода с кислородом в присутствии паров ртути облучать светом ртутной дуги, то основным продуктом реакции оказывается перекись водорода. Этот результат впоследствии был подтвержден другими исследователями ( 8488), показавшими, что реакция образования перекиси водорода и воды является цепной. [26]
Согласно теории цепных реакций наряду с конечными продуктами окисления образуются нестойкие промежуточные соединения, которые, распадаясь с выделением тепла, становятся очагами новых реакций окисления. В результате непрерывного повторения этих реакций возникают цепи со множеством активных центров, самоускоряющих реакцию образования перекисей. [27]
Это происходит потому, что с увеличением температуры разложзниз порекисных радикалов по уравнениям ( 21) и ( 23) становится более вероятным, чем реакции образования насыщенных перекисей, способных вызыв-ать разветвление цепи путем расщепления по связи О-О. Отсюда можно объяснить, почему с увеличением температуры при сохранении всех прочих условий неизменными наблюдается переход от температурного интервала, в котором имеет место максимальная скорость разпзтвления цепи, характеризующаяся в определенных условиях интенсивными холодными пла-менами, к температурному интервалу со слабо выраженным разветвлением цепи. Следует обсудить две стороны явления холодного пламени. Во-первых, скорость реакции не становится стационарной даже в случае обрыва цепей на поверхности. Это свидетельствует о том, что с точки зрения кинетики реакция разветвления имеет более высокий порядок, чем реакция обрыва цепи. Этому соответствует предположение, что разветвление цепи происходит посредством реакции конденсации альдегида и перекиси, поскольку скорость возникновения активных центров в этом случае пропорциональна произведению концентраций двух промежуточных реакционных продуктов, а скорость обрыва цепи пропорциональна первой степени концентрации активных центров. Во-вторых, холодные пламена прекращаются до полного высвобождения химической энтальпии. В соответствии с ранее высказанным мнением о неэффективности радикала СНО как активного центра и фактом ингибирования реакции в период ri формальдегидом, мы полагаем, что холодные пламена гасятся их собственным продуктом реакции - формальдегидом, который, реагируя с активными свободными радикалами типа ОН или СН30, образует неактивный радикал СНО. [28]
При изучении влияния температуры показано, что в пределах - 35ч - 8 С выход перекиси водорода ( по кислороду) и ее концентрация практически не изменяются. При 8 С получена 80 % - ная перекись водорода. Вычислена энергия активации реакции образования перекиси водорода в тихом разряде, равная 1200 кал / моль. Такое низкое значение совпадает с энергией активации при фотохимическом образовании перекиси, что указывает на общие черты активации в обоих случаях. Обнаружено увеличение потребления кислорода на образование Н2О2 при уменьшении содержания кислорода, а также благоприятное влияние добавок водяного пара ( 100 мм рт. ст.) и резко отрицательное влияние добавок азота. Аргон в малых концентрациях как будто бы. [29]
При изучении влияния температуры показано, что в пределах - 35 8 выход перекиси водорода ( по кислороду) и ее концентрация практически не изменяются. При 8 получена 80 % - пая перекись водорода. Вычислена энергия активации реакции образования перекиси водорода в тихом разряде, равная 1200 кал / моль. Такое низкое значение совпадает с энергией активации при фотохимическом образовании перекиси, что указывает на общие черты активации в обоих случаях. [30]
Страницы: 1 2 3