Скорость - коррозия - железо
Cтраница 1
Скорость коррозии железа и магния в щелочных растворах по сравнению со скоростью коррозии в нейтральных и кислых растворах меньше, вследствие того, что гидроокиси этих металлов практически нерастворимы в щелочах и образуют на поверхности металлов защитную пленку. При очень больших концентрациях щелочи, особенно при высоких температурах, железо начинает довольно интенсивно корродировать; его амфотерность проявляется только в концентрированных щелочных растворах ( фиг. [1]
Скорость коррозии железа в нейтральных растворах не зависит от рН; это объясняется тем. [2]
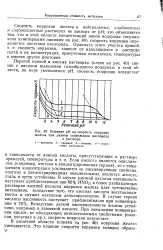 |
Влияние рН на скорость коррозии. [3] |
Скорость коррозии железа в нейтральных, слабокислых и слабощелочных растворах не зависит от рН; это объясняется тем, что в этой области концентраций ионов водорода ( ограничена пунктирными линиями на рис. 40) скорость коррозии определяется доступом кислорода. [4]
Скорость коррозии железа сернистыми соединениями увеличивается с ростом температуры, давления и турбулентности потока. [5]
Скорость коррозии железа в деаэрированной минерализованной воде при обычной температуре составляет 0 02 - 0 002 мм / год. При наличии в среде только сероводорода скорость коррозии железа достигает 0 3 - 0 5 мм / год. Фактическая же скорость коррозии действующего оборудования достигает 1 0 - 1 5 мм / год и выше. [6]
Скорость коррозии железа в щелочных растворах при рН 10 резко снижается вследствие образования нерастворимых гидратов закиси железа. Однако при рН 14 наблюдается увеличение коррозии из-за растворения продуктов коррозии в концентрированной щелочи с образованием ферритов. В нейтральной и близкой к нейтральной среде ( рН 5 - 9) скорость коррозии железа почти не зависит от рН раствора и в большей степени определяется наличием кислорода в растворе или его доступом в раствор. [7]
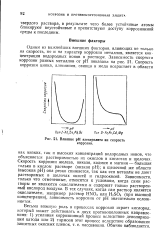 |
Влияние рН электролита на скорость коррозии. [8] |
Скорость коррозии железа, никеля, кадмия и магния - большая только в кислом растворе ( низкая рН); в щелочной же области ( высокая рН) она резко снижается, так как эти металлы не дают растворимых в щелочах окисей и гидроокисей. Зависимости, только что отмеченные, относятся к условиям, когда сами растворы не являются окислителями и содержат только растворенный кислород воздуха. В тех случаях, когда сам раствор является окислителем, например раствор HNO3 или H2SO4 ( при высокой концентрации), зависимость коррозии от рН значительно осложняется. [9]
Скорость коррозии железа Армко и малоуглеродистой стали при температуре 450 - 500 в чистых солях не превышает 0 83 мм / год, а в солях, содержащих значительные количества железа - 1 5 мм / год. [10]
Скорость коррозии железа в воде, не содержащей растворенный кислород, практически ничтожна. [11]
Скорость коррозии железа и железоуглеродистых сплавоп в минеральных кислотах зависит от характера образующихся продуктов коррозии - - растворимых или нерастворимых в данной среде. Так, соляная кислота по отношению к железу является неокислительной кислотой и коррозионный процесс протекает с образованием растворимых продуктов коррозии, не обладающих защитными свойствами. Скорость коррозии с повышением концентрации НС1 возрастает г, экспоненциальной зависимости. [12]
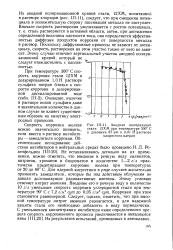 |
Анодная поляризация. [13] |
Скорость коррозии железа можно значительно понизить, если ввести в раствор ингибиторы - замедлители коррозии. [14]
Скорость коррозии железа в деаэрированной минерализованной воде при обычной температуре составляет 0 02 - 0 002 мм / год. При наличии в среде только сероводорода скорость коррозии железа достигает 0 3 - 0 5 мм / год. Фактическая же скорость коррозии действующего оборудования достигает 1 0 - 1 5 мм / год и выше. [15]
Страницы: 1 2 3 4 5