Скорость - коррозия - железо
Cтраница 2
Скорость коррозии железа в воде, не содержащей растворенный кислород, практически ничтожна. [16]
Скорость коррозии железа и железоуглеродистых сплавов з минеральных кислотах зависит от характера образующихся продуктов коррозии - растворимых или нерастворимых в данной среде. Так, соляная кислота по отношению к железу является не-окислителыюй кислотой и коррозионный процесс протекает с образованием растворимых продуктов коррозии, не обладающих защитными свойствами. [17]
Скорость коррозии железа при первом смачивании растет во времени и достигает максимума в момент исчезновения видимой пленки влаги. Затем наблюдается резкий спад тока коррозии, что может быть связано с торможением анодного процесса. При вторичном увлажнении максимум скорости растворения железа наблюдается уже в том случае, когда на поверхности металла присутствует пленка электролита определенной толщины. С каждым последующий смачиванием металлической поверхности максимальная скорость коррозии железа соответствует большей толщине слоя электролита. Положение максимума скорости коррозии железа можно условно рассматривать как время, когда меняется характер контроля коррозионного процесса. [18]
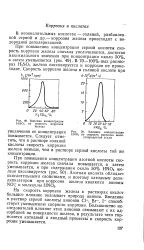 |
Влияние концентрации. [19] |
На скорость коррозии железа в растворах кислот большое влияние оказывает природа аниона. Введение в раствор серной кислоты анионов С1 -, Вг -, 1 - способствует уменьшению скорости коррозии. Большинство исследователей влияние этих анионов связывают с их адсорбцией на поверхности железа, в результате чего тормозятся катодный и анодный процессы и скорость коррозии уменьшается. [20]
На скорость коррозии железа в растворах кислот большое влияние оказывают многие органические вещества. Действие органических ингибиторов связано с их адсорбцией. Наиболее эффективными ингибиторами коррозии железа в растворах кислот являются органические соединения, содержащие серу, азот, фосфор, кислород, а также соединения с ненасыщенными связями. В настоящее время в промышленности находят широкое применение такие ингибиторы, как ПБ-5, ПК. [21]
На скорость коррозии железа в растворах HgSO как и в других кислотах, влияет природа анионов, что связано с их адсорбцией на поверхности металла и торможением катодного и анодного процессов. [22]
Зависимость скорости коррозии железа и углеродистых сталей от концентрации солей в нейтральных растворах имеет вид кривой с максимумом вследствие уменьшения растворимости деполяризатора - кислорода при увеличении концентрации активирующих анионов. Установлено, что максимальная скорость коррозии наблюдается в 3 - 4 % - ных растворах хлоридов. [23]
Зависимость скорости коррозии железа и углеродистых сталей от концентрации хлоридов и сульфатов нейтральных растворов имеет вид кривых с максимумом ( см. рис. 242), зависящим от природы растворенной соли. С ростом концентрации солей увеличивается концентрация ионов хлора, сульфата и аммония, активирующих и облегчающих анодный процесс, и уменьшается растворимость деполяризатора кислорода ( см. рис. 162), что затрудняет протекание катодного процесса. В каком-то интервале концентраций сильнее сказывается первый эффект, а затем преобладает второй. [24]
Повышение скорости коррозии железа по мере понижения рН связано не только с облегчением выделения водорода. Вследствие растворения поверхностного окисла облегчается доступ кислорода к поверхности металла, это увеличивает кислородную деполяризацию. [25]
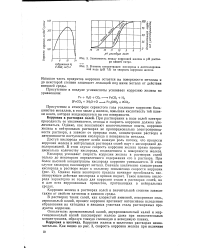
 |
Зависимость защитной концентрации нитросоединений для стали от. [26] |
Изменение скорости коррозии железа с ростом температуры происходит в отсутствие ингибитора по закону, уже неоднократно отмечавшемуся в литературе: непрерывный рост коррозии наблюдается при повышении температуры до 50 - 60 С; при дальнейшем повышении температуры скорость коррозии вследствие уменьшения растворимости кислорода падает. При введении в электролит нитрита натрия картина меняется: при малых концентрациях, не достаточных для полного подавления процесса, коррозия с ростом температуры непрерывно увеличивается. Вполне возможно, что при повышенных температурах перенапряжение для реакции восстановления нитрита натрия уменьшается; ингибитор начинает с небольшой скоростью восстанавливаться, поэтому ограниченная растворимость кислорода уже не может стать тем фактором, который лимитирует скорость коррозии. [27]
Возрастание скорости коррозии железа по мере уменьшения рН обусловлено не только увеличением скорости выделения водорода; в действительности облегченный доступ кислорода к поверхности металла вследствие растворения поверхностного оксида усиливает кислородную деполяризацию, что нередко является более важным фактором. В окисляющих кислотах, например в азотной, действующих как деполяризаторы, для которых скорость коррозии не зависит от концентрации растворенного кислорода, это отношение близко к единице. В общем, чем более разбавлена кислота, тем больше отношение скоростей коррозии в присутствии и в отсут - ствие кислорода. В концентрированных кислотах скорость выделения водорода так велика, что затрудняется доступ к поверхности металла. Поэтому деполяризация в концентрированных кислотах в меньшей степени способствует увеличению скорости коррозии, чем в - разбавленных, где диффузия кислорода идет о большей легкостью. [28]
Зависимость скорости коррозии железа от содержания растворенного кислорода носит линейный характер. [29]
 |
Зависимость между коррозией железа и рН раствора едкого натра. с ч.| Влияние концентрации кислорода в дистиллированной воде ( рН 7 0 на скорость коррозии железа. [30] |
Страницы: 1 2 3 4 5