Скорость - разложение - перекись
Cтраница 2
Кистяковский [76] изучал катализ под действием ферроцианид-феррицианидных смесей и наблюдал, что скорость разложения перекиси значительно возрастает при облучении растворов светом. Более того, это высокое значение константы сохраняется, если облучение прекратить. Ферроцианид обнаруживает тот же самый эффект в отсутствие феррицианида, однако последний отдельно не исследовался. Кистяковский сделал вывод о том, что катализатор образовывался в результате освещения, и предположил, что он, повидимому, имеет коллоидную природу. Винтер [77] и Вейгерт [78] также объяснили это явление присутствием катализатора, однако не приводят сведений о его природе. [16]
Авторы рассмотрели две причины, позволяющие объяснить увеличение скорости инициирования: рост скорости разложения перекиси на поверхности раздела фаз и рост эффективности инициирования. [17]
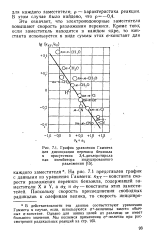 |
График уравнения Гаммета для диссоциации перекиси бензоила в присутствии 3 4-дихлорстирола как ингибитора индуцированного разложения. [18] |
На рис. 7.1 представлен график с данными из уравнения Гаммета: KXY - константа скорости разложения перекиси бензоила, содержащей заместители X и Y, а ах и OY - константы этих заместителей. [19]
Используя метод Нозаки и Бартлета [82], авторы работы [73] рассчитали отдельно значения констант скорости цепного и нецепного разложения исследуемой перекиси, а также значение кажущейся энергии активации этих процессов. Для нецепного разложения исследуемой перекиси значение кажущейся энергии активации составляет 31 7 ккал, а для цепного разложения - 43 4 ккал. [20]
В случае применения диалкил -, алкиларалкил - или диаралкил-перекисей температура вулканизации должна быть не ниже 140 С; ниже этой температурной границы скорость разложения перекиси, а следовательно, и скорость вулканизации совершенно недостаточны. С другой стороны, температура не должна значительно превышать 150 С, иначе у вулканизатов различных типов смесей уже наблюдаются явления реверсии, в результате чего могут ухудшиться физико-механические свойства. [21]
Недавно проведенное исследование этого предположения [173] показало, что добавка метилового спирта действительно способствует разделению, но этот эффект обусловлен, по-видимому, снижением температуры кипения смеси, уменьшающим скорость разложения перекиси, а не просто образованием ацеталей. Однако заметное разложение все же наблюдается, и процесс может оказаться взрывоопасным. [22]
Они отмечают, что в системе бромид - бром имеет место постепенное увеличение стационарной концентрации брома по мере убывания концентрации перекиси, причем одновременно с этим незначительно уменьшается константа скорости разложения перекиси. Подтверждений илиопроверзкений результатов этой работы не имеется. [23]
При детальном исследовании озонирования поливинилхлорида ( 18 мг 03 / л 02) определена максимальная концентрация образующейся перекиси - 1 0 - 10 - 4 моль / г. При 25 константа скорости разложения перекиси 4 6 - 10 - 7 сек 1 и энергия активации 19 8 ккал / молъ. Разложение перекиси ускоряется хлористым водородом или винилиденхлоридом, но уменьшается в присутствии акрилонитрила. В результате такой обработки может происходить понижение молекулярного веса. Скорость прививки мономеров уменьшается в следующем ряду: акриловая кислота винили-денхлорид метилакрилат метилметакрилат акрилонитрил стирол; винилацетат. [24]
При рассмотрении вопроса о материалах, пригодных для изготовления того или иного аппарата, приходящего в контакт с перекисью водорода, необходимо учитывать два следующих фактора: 1) влияние материала на скорость разложения перекиси и 2) влияние, оказываемое перекисью водорода на этот материал. [25]
Катализаторами разложения помимо H2S04 могут быть все сильные кислоты и кислоты Льюиса. Скорость разложения перекиси с увеличением концентрации кислоты возрастает. [26]
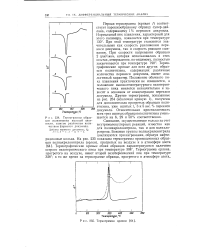 |
Термограмма орлона. [27] |
Первая термограмма ( кривая /) соответствует порошкообразному образцу супер-дай-лана, содержащему 1 % перекиси дикумила. При этой температуре становятся значительными как скорость разложения перекиси дикумила, так и скорость реакции сшивания. [28]
Более подробное исследование термического разложения ди-трет. Это отчетливо проявляется в увеличении значения константы скорости разложения крем-нийорганической перекиси при повышении ее начальной концентрации. Кроме того, оказалось, что проявляется вполне ощутимый эффект растворителя. Он проявляется в том, что скорость термического разложения кремний-органических перекисей, содержащих винильный радикал, возрастает в ряду органических растворителей: ку-мол этилбензол толуол. [29]
Если большая часть радикалов реагирует по реакции 10, за которой следует очень быстрая реакция 11, то распад каждой молекулы ди-т / етге-бутилперекиси ( реакция 1) приводит к образованию двух молекул СН4, двух молекул ацетона и двух дибутилгидроперекисных радикалов или к увеличению скорости в 3 раза. Отмечено, что НВг не оказывает влияния на скорость разложения перекиси. [30]
Страницы: 1 2 3