Скорость - разложение - перекись
Cтраница 3
Если большая часть радикалов реагирует по реакции 10, за которой следует очень быстрая реакция И, то распад каждой молекулы ди-дарет / г-бутидперекиси ( реакция 1) приводит к образованию двух молекул СН4, двух молекул ацетона и двух дибутилгидроперекисных радикалов или к увеличению скорости в 3 раза. Отмечено, что НВг не оказывает влияния на скорость разложения перекиси. [31]
По-видимому, механизм реакции между германием и перекисью водорода различен при наличии и в отсутствие щелочи. В присутствии щелочи наблюдается ясно выраженная корреляция между скоростью разложения перекиси - водорода и скоростью реакции германия с перекисью водорода. [32]
Некоторые соединения металлов значительно ускоряют окисление; очень активны соединения железа, кобальта, никеля, меди и марганца. С этой точки зрения действие таких соединений, вероятно, проявляется в увеличении скорости разложения перекиси. [33]
На рис. 38, заимствованном из работы [2], показано действие на процесс автоокисления такого типа антиокислителей, влияющих только на начальную стадию процесса. Авторы связывают ограниченное действие этого типа антиокислителей с тем, что они не способны влиять на скорость разложения перекисей, и антиокислительный эффект их обусловливается только подавлением зарождения активных частиц ( радикалов) в начальной стадии процесса. [34]
 |
Характеристика коллоидного кремнезема. [35] |
Метод был стандартизирован путем применения посеребренных образцов стеклянных микрошариков, приготовленных по методу Блюмквиста и Кларка [60] и имевших размеры, точно определенные по методу, описанному выше. Измерение предельной скорости осаждения и веса стеклянных шариков на миллилитр суспензии дает их средний радиус и поверхность на грамм. Поверхность кремнезема была получена путем сравнения скорости разложения перекиси для двух посеребренных материалов. [36]
Скорость разложения особенно увеличивается с повышением температуры. Некоторые материалы оказывают ускоряющее действие на процесс разложения перекиси. К таким материалам относятся медь и ее сплавы, свинец и др. Такие материалы, как простая углеродистая и нержавеющая стали, в меньшей степени, чем медь и свинец, но также способствуют ускорению реакции разложения перекиси водорода. Скорость разложения перекиси, находящейся в соприкосновении с металлами и неметаллическими материалами, зависит не только от их химической природы, но также и от состояния поверхности материалов. Задиры, заусенцы и другие дефекты обработки являются причиной, ускоряющей ее разложение. [37]
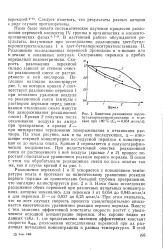 |
Кинетика разложения трет-бутилперокситриэтилсилана в н-де-кане при 180 С ( Са 0 054 моль / л. [38] |
В настоящей работе обсуждаются-результаты, полученные при исследовании разложения трет-бутил-перокситриэтилсилана I и грет-бутилперокситриэтилстаннана II. Содержание перекиси в пробах определяли иодометрически. Скорость разложения перекисей сильно зависит от степени очистки реакционной смеси от раство-реннего в ней кислорода. [39]
Скорость термического распада перекиси зависит от природы растворителя. Наибольшая скорость наблюдается в растворе ТГФ, где за 1 ч при 70 С разлагается, практически, вся перекись. Термический распад перекиси протекает согласно уравнению первого порядка. Отсутствует зависимость скорости разложения перекиси от начальной концентрации ее в растворителе. [40]
Природа ад-дендов существенно меняет каталитическую активность полимера. Состав органического радикала, хотя он и не связан непосредственно с металлом, может влиять на изменение активности катализатора на три-четыре порядка. Исследование влияния рН среды на скорость разложения перекиси показало, что при под-щелачивании имеет место ускорение каталитического процесса. [41]
Поскольку при окислении постоянно образуются новые количества перекисей, этот процесс протекает автокаталитически. Вторая фаза реакции - распад гидроперекиси - тоже катализируется солями марганца, как это установили Лангенбек и Притцков. Итак, соли марганца являются катализаторами образования и распада гидроперекисей и можно принять, что последняя реакция тоже протекает по радикально-цепному механизму, поскольку фенолы и амины ее подавляют. Органические кислоты никак не влияют на скорость разложения перекисей. Интересно еще то, что происходящее при распаде гидроперекисей, например гидроперекиси тетралина, побочное образование спиртов в присутствии солей марганца как катализаторов больше, чем в случае некатализируемой реакции. [42]
Стекло весьма инертно и с успехом применяется для хранения и транспортировки перекиси водорода различной концентрации. Основным недостатком его является хрупкость. Стекло с высоким содержанием силиката, например боросиликатное ( стекло пирекс), вызывает меньшее разложение перекиси, чем более щелочное натриевое стекло; сосуды из стекла щелочного типа не подходят для хранения высококонцентрированной перекиси. Эмалированные сосуды находят применение для разбавленной перекиси; можно думать, что они ведут себя аналогично натриевому стеклу. Скорость разложения перекиси увеличивается при действии солнечного света; для снижения влияния этого фактора часто применяют цветную стеклянную тару. [43]
Работами различных исследователей с очевидностью установлено, что чистая перекись водорода любой концентрации, свободная от загрязняющих катализаторов, в совершенно чистом сосуде из некаталитического материала представляет собой весьма устойчивое соединение. Так, типовые данные, полученные для высококачественной нестабилизированной перекиси водорода, находившейся в сосуде с отношением поверхности к объему 0 7 см 1, показывают, что скорость разложения 90 % - ной перекиси водорода при 50 не превышает 0 0010 % в час, а возможно даже значительно меньшего процента. Соответствующее значение при 30 равно примерно 0 00006 % в час, или около 0 5 % в год. Тщательные измерения, проведенные с применением нестабилизированной, менее концентрированной перекиси водорода, полученной путем разбавления возможно более чистых концентрированных растворов очень чистой водой, показали, что скорость разложения ( в процентах) возрастает лишь слабо в интервале концентраций от 95 до 40 % перекиси водорода. Однако если вода, использованная для разбавления, не подвергнута особо тщательной очистке или разбавление не проведено с достаточной тщательностью, чтобы устранить возможность заметного загрязнения, то скорость разложения разбавленной перекиси может оказаться значительно больше скорости разложения начального концентрированного раствора. Так, Жигер и Жоффрион [2] наблюдали, что при разбавлении нестабилизированной перекиси водорода дважды дистиллированной водой получаются растворы, которые неизменно обладают заметно повышенной способностью к разложению, а поэтому для обеспечения стабильности, требующейся при измерении показателя преломления растворов, необходимо добавлять к ним небольшое количество станната натрия. Точно доказано, что, хотя скорость разложения наилучшим образом очищенных растворов перекиси водорода и очень низка, практически, конечно, невозможно достичь таких идеальных условий, как совершенная чистота раствора и полное отсутствие каталитического эффекта со стороны стенок сосуда или же растворенных или взвешенных примесей; в связи с этим наилучшие из имеющихся данных относительно стабильности, присущей самой перекиси водорода, нужно рассматривать, с одной стороны, лишь как приближение к идеально достижимым результатам, а с другой-как цель, к которой следует стремиться в условиях производства, хранения и перевозки. [44]
Страницы: 1 2 3