Скорость - растворение - титан
Cтраница 2
Скорость растворения карбида титана в этой области значительно меньше скорости растворения титана в пассивной области. [16]
 |
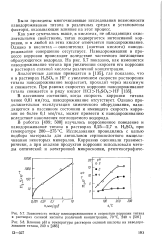
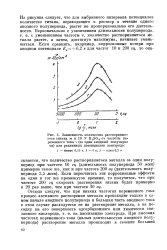
Изменение скорости растворения титана iK в 10 N НС1 с изменением анодных и катодных потенциалов при различных частотах. [17] |
В результате этого степень пассивации поверхности электрода оказывается ниже, а скорость растворения титана гораздо выше, чем при низких частотах. [18]
В области концентраций серной кислоты, соответствующей 60 - 62 % ( см. рис. 1), скорость растворения титана меньше, чем в 40 % - ном растворе. [19]
Аналогичные данные приводятся в [135], где показано, что и в растворах HsSCU и HF с увеличением скорости растворения титана наводороживание возрастает, проходит через максимум и снижается. [21]
Если пересчитать эти коррозионные эффекты на один и тот же промежуток времени, то получится, что при частоте 200 гц скорость растворения титана будет примерно в 20 раз выше, чем при частоте 10 гц. [23]
Анализ результатов испытаний ( рис. 1 - 3 табл.) показывает, что состав растворов солей при их подкислении значительно влияет как на устойчивость пассивного состояния, так и на скорость растворения титана. [24]
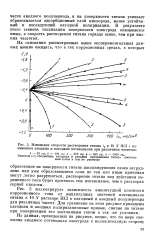
Из сопоставления анодных поляризационных кривых, приведенных на этом рисунке, можно заключить, что в отличие от постоянного тока, для которого смещение потенциала электрода в анодную сторону приводит к непосредственной пассивации металла, для переменного тока по мере смещения потенциала в положительную сторону наблюдается увеличение скорости растворения титана. Характерно, что однозначной связи между потенциалом электрода в анодный полупериод тока и скоростью растворения титана при различных частотах переменного тока, в отличие от железа, не имеется. Как было показано в работе [5], при растворении железа в кислых средах данному значению потенциала электрода в анодный полупериод при всех частотах соответствует одна и та же скорость коррозии. При растворении же титана, как это следует из рис. 3, данному значению анодного потенциала электрода соответствует тем большая скорость коррозии, чем выше частота наложенного переменного тока. [25]
Далее из рис. 3 следует, что для частот 10 - 500 гц смещение потенциала электрода в положительную сторону от его стационарного значения вначале сопровождается увеличением тока коррозии, затем последний достигает предельного значения, и дальнейшее смещение потенциала в положительную сторону уже не приводит к возрастанию скорости растворения титана. Более того, с увеличением плотности наложенного переменного тока, когда потенциал электрода в анодный полупериод смещается далеко в положительную сторону, при низких частотах наблюдается уменьшение тока коррозии, так как в этом случае большую часть анодного полупериода электрод находится в пассивном состоянии. [26]
Фтористоводородная кислота является по отношению к титану наиболее агрессивной средой. Скорость растворения титана в плавиковой кислоте различных ( концентраций возрастает со временем, а после достижения максимального значения уменьшается. Величина максимальной скорости коррозии титана возрастает по мере повышения концентрации кислоты ( фиг. [27]
Автор [41] подчеркивает хорошее согласие результатов определения скорости растворения титана в серной кислоте при 60 С весовым методом и по току, но ничего не говорит о том, что при достаточно отрицательных потенциалах найденная зависимость тока от потенциала нарушается. Вместо закономерного снижения при смещении потенциала в сторону отрицательных значений скорость растворения перестает изменяться. [28]
Из сопоставления анодных поляризационных кривых, приведенных на этом рисунке, можно заключить, что в отличие от постоянного тока, для которого смещение потенциала электрода в анодную сторону приводит к непосредственной пассивации металла, для переменного тока по мере смещения потенциала в положительную сторону наблюдается увеличение скорости растворения титана. Характерно, что однозначной связи между потенциалом электрода в анодный полупериод тока и скоростью растворения титана при различных частотах переменного тока, в отличие от железа, не имеется. Как было показано в работе [5], при растворении железа в кислых средах данному значению потенциала электрода в анодный полупериод при всех частотах соответствует одна и та же скорость коррозии. При растворении же титана, как это следует из рис. 3, данному значению анодного потенциала электрода соответствует тем большая скорость коррозии, чем выше частота наложенного переменного тока. [29]
Сопоставление скорости растворения титана при стационарном потенциале со скоростью растворения при потенциалах в области устойчивой пассивности показывает, что анодная защита позволяет снизить скорость коррозии в 15 - 30 раз. Плотность анодного тока в данном случае не может служить количественной характеристикой коррозионного процесса, поскольку одновременно осуществляется процесс анодного окисления ионов Сг2 до Сг3, скорость которого в 85 раз превышает скорость растворения титана в области устойчивой пассивности. [30]
Страницы: 1 2 3